1 . 根据相应信息回答有关问题。
I.物质结构和规律推断
如图为周期表中短周期的一部分,已知A是地壳中含量最多的元素。
(1)比较A、C的原子半径大小_______ (用原子符号表示)。
(2)比较C、D的简单氢化物的稳定性_______ (用化学式表示)。
II.实验操作和现象分析
(3)配制100ml0.1mol/L的NaOH溶液时,若仰视定容,则所配溶液的物质的量浓度_______ (填“偏大”、“偏小”或“不变")。
(4)将适量Ba(OH)2•8H2O晶体与NH4Cl晶体放入烧杯中,用玻璃棒快速搅拌,试着拿起烧杯观察,晶体变成糊状,此外还可观察到_______ 等现象。
III物质性质和成分探究
(5)将二氧化硫气体通入到品红溶液中,溶液褪色,体现了二氧化硫的_______ 性。
(6)在实验室,浓硝酸保存在棕色试剂瓶中,因浓硝酸见光或受热易分解,产生有刺激性气味的红棕色气体,该气体为_______ (用化学式表示)。
I.物质结构和规律推断
如图为周期表中短周期的一部分,已知A是地壳中含量最多的元素。
| A | ||
| B | C | D |
(1)比较A、C的原子半径大小
(2)比较C、D的简单氢化物的稳定性
II.实验操作和现象分析
(3)配制100ml0.1mol/L的NaOH溶液时,若仰视定容,则所配溶液的物质的量浓度
(4)将适量Ba(OH)2•8H2O晶体与NH4Cl晶体放入烧杯中,用玻璃棒快速搅拌,试着拿起烧杯观察,晶体变成糊状,此外还可观察到
III物质性质和成分探究
(5)将二氧化硫气体通入到品红溶液中,溶液褪色,体现了二氧化硫的
(6)在实验室,浓硝酸保存在棕色试剂瓶中,因浓硝酸见光或受热易分解,产生有刺激性气味的红棕色气体,该气体为
您最近一年使用:0次
解题方法
2 . A、B、D、E、F为短周期元素,非金属元素A的最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物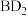 。
。 与
与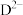 具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是_______ ;常温下F的单质和NaOH溶液反应的产物中氧化产物与还原产物的物质的量之比为_______ 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______ ,其与等物质的量的F单质在水中反应的离子方程式为_______
(3)元素A、B、D组成的2种化合物都是厨房中的常见物质,写出这2种化合物反应的化学方程式_______ 。
(4)由这些元素组成的物质;其组成和结构信息如下表:
a的电子式为_______ ;b与水反应的化学方程式为_______ 。
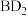 。
。 与
与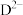 具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)A在周期表中的位置是
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为
(3)元素A、B、D组成的2种化合物都是厨房中的常见物质,写出这2种化合物反应的化学方程式
(4)由这些元素组成的物质;其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 由A和E形成的二元离子化合物 |
| b | 化学式为 |
您最近一年使用:0次
3 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W的简单氢化物与Z的单质混合在光照下反应,气体颜色不断变浅,瓶壁上有油状液滴,X的简单氢化物与Z的氢化物相遇会产生白烟。下列说法错误的是
| A.W的含氧酸的酸性一定比Z的弱 | B.四种元素中,Y的原子半径最大 |
| C.X的简单氢化物的热稳定性比Y的强 | D.“白烟”晶体中含有离子键和共价键 |
您最近一年使用:0次
名校
4 . 冰雪天气中常使用融雪剂,某种融雪剂主要成分的化学式为 ,X、Y为周期表1-20号内的元素,其阳离子和阴离子的电子层结构相同,且1 mol
,X、Y为周期表1-20号内的元素,其阳离子和阴离子的电子层结构相同,且1 mol  含有54 mol电子。
含有54 mol电子。
(1)该融雪剂的化学式是_______ ;X与氢元素形成的化合物的电子式是_______ 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,D的单质易溶于D与E形成的一种液态化合物,该液态化合物分子的结构式为_______ ;D所在族元素的氢化物中,沸点最低的是_______ 。
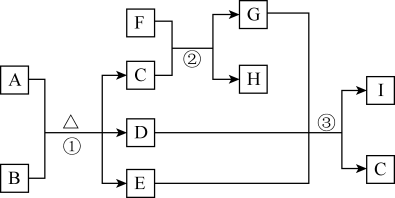
(3)元素W与Y同周期,其单质晶体结构类似于金刚石;元素Z的单质分子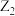 中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是
中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是_______ 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃, 与NaOH溶液反应的产物之一是
与NaOH溶液反应的产物之一是 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
 ,X、Y为周期表1-20号内的元素,其阳离子和阴离子的电子层结构相同,且1 mol
,X、Y为周期表1-20号内的元素,其阳离子和阴离子的电子层结构相同,且1 mol  含有54 mol电子。
含有54 mol电子。(1)该融雪剂的化学式是
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,D的单质易溶于D与E形成的一种液态化合物,该液态化合物分子的结构式为
(3)元素W与Y同周期,其单质晶体结构类似于金刚石;元素Z的单质分子
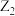 中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是
中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,
 与NaOH溶液反应的产物之一是
与NaOH溶液反应的产物之一是 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I 的组成元素相同,且D的相对分子质量比I的大16,E是最常见的无色液体。有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。请回答下列问题:
(1)A中所含元素在周期表中的位置___________ ,E的电子式为___________
(2)D、G、I中属于酸性氧化物的是(填化学式)___________
(3)写出反应①的化学方程式:___________
(4)写出反应③的离子方程式:___________
(5)38.4g F跟适量B的浓溶液反应,F完全反应,共收集到气体22.4L(不考虑2NO2⇌N2O4,气体体积已折算为标准状况),反应消耗B的物质的量是___________

(1)A中所含元素在周期表中的位置
(2)D、G、I中属于酸性氧化物的是(填化学式)
(3)写出反应①的化学方程式:
(4)写出反应③的离子方程式:
(5)38.4g F跟适量B的浓溶液反应,F完全反应,共收集到气体22.4L(不考虑2NO2⇌N2O4,气体体积已折算为标准状况),反应消耗B的物质的量是
您最近一年使用:0次
名校
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y的最低负价的绝对值与Z的最高正价相等,W与X同主族。下列说法正确的是
| A.原子半径:r(Z)>r(W)>r(X)>r(Y) |
| B.简单气态氢化物的热稳定性:X>Y>W |
| C.W与X元素可形成两种化合物 |
| D.X和Z可形成一种离子化合物,所含阴、阳离子个数比为1∶1 |
您最近一年使用:0次
2022-03-18更新
|
125次组卷
|
2卷引用:湖南省娄底市第四中学2021-2022学年高一下学期第一次月考化学试题
名校
7 . 已知:X、Y、Z、G、Q为原子序数依次增大的五种短周期主族元素;X、Y、Q的单质在常温下呈气态且X、Y位于同一周期;Y的最外层电子数是其电子层数的3倍;Y、Z的最外层电子数之和等于Q的最外层电子数;G是地壳中含量排第二的元素。请回答下列问题:
(1)Z在元素周期表中的位置为___________ ;X的单质的电子式为___________ 。
(2)X、G的非金属性强弱:___________ (填元素符号,下同)>___________ ,X、Y、Z、Q的原子半径由大到小的顺序为___________ 。
(3)上述元素的最高价氧化物对应水化物的酸性最强的是___________ (填化学式);化合物ZQY中含有的化学键的类型为___________ 。
(4)将化合物GY2加入Z的最高价氧化物对应水化物的溶液中,发生反应的化学方程式为___________ 。
(1)Z在元素周期表中的位置为
(2)X、G的非金属性强弱:
(3)上述元素的最高价氧化物对应水化物的酸性最强的是
(4)将化合物GY2加入Z的最高价氧化物对应水化物的溶液中,发生反应的化学方程式为
您最近一年使用:0次
2022-03-17更新
|
137次组卷
|
3卷引用:湖南省东安县第一中学2021-2022学年高一下学期3月份大联考化学试题
名校
8 . A、B、C、D、E、F是原子序数依次增大的前20号元素。元素A的周期数、主族序数、原子序数均相等;元素B的最高价氧化物对应水化物的化学式为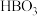 ;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物
;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物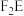 ;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
(1)F在周期表中的位置为:_______ ,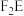 中F离子的结构示意图为
中F离子的结构示意图为_______ 。
(2)气态化合物 的电子式为
的电子式为_______ ,将 通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象
通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象_______ 。
(3)B、C、D三种元素的离子半径由大到小的顺序为:_______ (用离子符号表示)
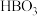 ;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物
;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物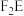 ;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。(1)F在周期表中的位置为:
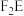 中F离子的结构示意图为
中F离子的结构示意图为(2)气态化合物
 的电子式为
的电子式为 通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象
通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象(3)B、C、D三种元素的离子半径由大到小的顺序为:
您最近一年使用:0次
2022-01-23更新
|
173次组卷
|
2卷引用:湖南省邵阳市邵东市2021-2022学年高一上学期期末统考化学试题
名校
9 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
(1)镁元素在周期表中的位置是_______ 。
(2)②的最高价氧化物的结构式为_______ 。
(3)④⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:_______ ;写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式_______ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能 具有的性质是_______(填字母)。
(5)已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数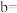
_______ (用含a的代数式表示)。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②的最高价氧化物的结构式为
(3)④⑤元素可形成既含离子键又含非极性共价键的离子化合物,写出该化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W
A.最高化合价为 |
B.简单气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
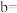
您最近一年使用:0次
2022-01-22更新
|
298次组卷
|
3卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
10 . A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子半径最小:B元素的一种单质是空气中含量最多的一种成分:D与A同主族;F元素原子的最外层电子数是其次外层电子数的 ;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
(1)B元素的原子结构示意图___________ ;E元素在周期表中的位置是___________ 。
(2)上述6种元素中,金属性最强的元素是___________ (写元素名称,下同):非金属性最强的元素是___________ 。
(3)A、B、C和F可组成一种化合物,其原子个数之比为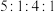 。写出该化合物的化学式
。写出该化合物的化学式___________ 。
(4)写出含E元素的氧化物与氢氧化钠溶液反应的离子方程式___________ 。
(5)由C、D两种元素形成的原子个数之比为 的化合物中,所含化学键的类型有
的化合物中,所含化学键的类型有___________ 。
 ;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:(1)B元素的原子结构示意图
(2)上述6种元素中,金属性最强的元素是
(3)A、B、C和F可组成一种化合物,其原子个数之比为
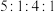 。写出该化合物的化学式
。写出该化合物的化学式(4)写出含E元素的氧化物与氢氧化钠溶液反应的离子方程式
(5)由C、D两种元素形成的原子个数之比为
 的化合物中,所含化学键的类型有
的化合物中,所含化学键的类型有
您最近一年使用:0次
2022-01-19更新
|
171次组卷
|
2卷引用:湖南省衡阳市衡阳县2021-2022学年高一上学期期末考试化学试题



