名校
解题方法
1 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分。请按要求回答下列问题:
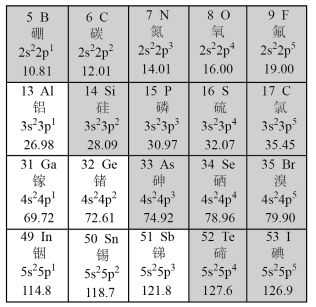
(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。根据硅元素在周期表中的位置请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硒元素和溴元素最高价氧化物水化物酸性较强的是___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。往氯化铝溶液中滴入过量氨水,写出该反应的离子方程式___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是_____
(6)小赵同学在研究元素周期表时发现,碳元素有“2s22p2”这一信息。观察元素周期表后,寻找规律,推测某元素“nsxnpy”中x+y可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷在周期表中的位置是
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。根据硅元素在周期表中的位置请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硒元素和溴元素最高价氧化物水化物酸性较强的是
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是_____
| A.“类钫”在化合物中显+1价 | B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”单质能与冷水剧烈反应 |
您最近一年使用:0次
名校
解题方法
2 . 离子液体因其不挥发性、无色、无臭、较好的化学稳定性被誉为二十一世纪的绿色化学溶剂,某离子液体(结构如下)在触觉传感器中应用广泛。X、Y、Z均为短周期主族元素,原子序数依次增大,Y是非金属性最强的元素。下列说法正确的是
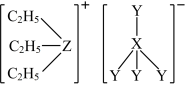
| A.原子半径:X>Y>Z |
| B.最高价氧化物的水化物的酸性:Y>Z>X |
| C.简单氢化物的沸点:Y>Z |
| D.该离子液体中各元素原子均满足8电子稳定结构 |
您最近一年使用:0次
2024-02-25更新
|
129次组卷
|
2卷引用:2024届福建省福州延安中学高三下学期高考第二次模拟化学试题
名校
3 . 下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)⑧的最高价氧化物的水化物的化学式是___________ 。
(2)④、⑤、⑥、⑦四种元素的离子半径由大到小排序___________ (写离子符号)。
(3)元素③、④形成的简单气态氢化物的稳定性中较大的是___________ (填化学式)。
(4)⑤和③的最高价氧化物的水化物之间发生反应的离子方程式为___________ 。
(5)下列事实能判断⑤和⑥的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与④同主族。下列推断正确的是___________ 。
a. 只具有还原性
只具有还原性
b.Se的最低负化合价是-2价
c.Se的最高价氧化物对应水化物的酸性比 强
强
(7)同温同压下,0.2mol的⑤、⑥、⑦单质分别与100mL1mol/L的盐酸充分反应,产生氢气的体积比为___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑤、⑥、⑦四种元素的离子半径由大到小排序
(3)元素③、④形成的简单气态氢化物的稳定性中较大的是
(4)⑤和③的最高价氧化物的水化物之间发生反应的离子方程式为
(5)下列事实能判断⑤和⑥的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与④同主族。下列推断正确的是
a.
 只具有还原性
只具有还原性 b.Se的最低负化合价是-2价
c.Se的最高价氧化物对应水化物的酸性比
 强
强(7)同温同压下,0.2mol的⑤、⑥、⑦单质分别与100mL1mol/L的盐酸充分反应,产生氢气的体积比为
您最近一年使用:0次
名校
解题方法
4 . 已知短周期元素的离子: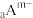 、
、 、
、 、
、 (m>n)都具有相同的电子层结构,则下列叙述正确的是
(m>n)都具有相同的电子层结构,则下列叙述正确的是
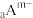 、
、 、
、 、
、 (m>n)都具有相同的电子层结构,则下列叙述正确的是
(m>n)都具有相同的电子层结构,则下列叙述正确的是| A.原子半径:B>A>C>D | B.离子半径:A>B>D>C |
| C.原子序数:D>C>B>A | D.单质的还原性:A>B>D>C |
您最近一年使用:0次
2024-02-17更新
|
177次组卷
|
2卷引用:福建省漳州实验中学2023-2024学年高一下学期4月期中考试化学试题
名校
5 . 已知X、Y为第三周期元素,且电负性X>Y,下列说法正确的是
| A.第一电离能Y一定小于X |
| B.简单气态氢化物的稳定性:X>Y |
| C.最高价含氧酸的酸性:Y>X |
| D.X和Y形成化合物时,X显正价,Y显负价 |
您最近一年使用:0次
2024-02-11更新
|
181次组卷
|
5卷引用:福建省南平市浦城第一中学2023-2024学年高二下学期4月期中考试化学试题
福建省南平市浦城第一中学2023-2024学年高二下学期4月期中考试化学试题山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题江西省部分学校2023-2024学年高二上学期1月期末化学试题(已下线)1.2.2 元素周期律课堂例题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
6 . 短周期主族元素W、M、X、Y、Z原子序数依次增大。W的p能级半充满,M原子的s能级电子数和p能级相等,X是同周期电负性最小的元素,Y是同周期离子半径最小的元素,Z只有一个未成对电子。下列说法不正确的是
A.第一电离能: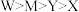 |
| B.W、M两种元素氢化物的稳定性:W<M |
| C.M、X组成的常见化合物中阴阳离子个数比均为1:2 |
| D.X、Y、Z的最高价氧化物对应水化物可以相互反应 |
您最近一年使用:0次
2024-02-11更新
|
200次组卷
|
2卷引用:福建师范大学附属中学2023-2024学年高三上学期12月月考化学试卷
名校
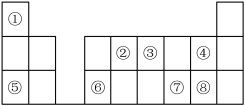
7 . 下图是元素周期表的一部分。按要求填写下列空白:______ 。
(2)①~⑧元素的最高价氧化物中,具有两性的是_______ (填化学式)。
(3)元素⑦的最简单气态氢化物的电子式是_______ ;元素③形成单质的电子式_____ 。
(4)④、⑤、⑥、⑦对应简单离子的半径最小的是_______ (填离子符号)。
(5)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式______ 。
(6)下列方案中不能证明非金属性⑧比⑦强的是_____(填选项字母)。
(2)①~⑧元素的最高价氧化物中,具有两性的是
(3)元素⑦的最简单气态氢化物的电子式是
(4)④、⑤、⑥、⑦对应简单离子的半径最小的是
(5)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式
(6)下列方案中不能证明非金属性⑧比⑦强的是_____(填选项字母)。
| A.最高价氧化物对应水化物的酸性⑧比⑦的强 |
| B.单质与变价金属反应,产物的价态⑧比⑦的高 |
| C.简单气态氢化物对应水溶液的酸性⑧比⑦的强 |
| D.⑧的单质可将⑦的单质从其化合物中置换出来 |
您最近一年使用:0次
2024-01-19更新
|
32次组卷
|
2卷引用:福建省莆田锦江中学2023-2024学年高一下学期3月月考化学试题
名校
8 . 已知:X、Y、Z三种元素的质子数依次增大,且均小于18。X元素的原子最外层电子数是电子层数的2倍,且常温下X的单质为固体;Y元素的原子的最外层电子数与其K层的电子数相等;Z元素的原子得到1个电子,所得到的微粒具有与氩原子相同的电子层结构。下列说法正确的是
A. 的单质中含 的单质中含 质子 质子 |
B.Y的单质不能与 反应 反应 |
| C.X元素的氧化物都是酸性氧化物 |
D.化合物 属于非电解质 属于非电解质 |
您最近一年使用:0次
2024-01-16更新
|
379次组卷
|
2卷引用:福建省莆田第一中学2023-2024学年高一上学期期中考试化学试题
名校
9 . 下列说法正确的是
| A.所有非金属元素都分布在p区 |
| B.最外层只有一个电子的原子X和Y性质一定相似 |
| C.2p轨道上只有一个电子的X原子和3p轨道上只有一个电子的Y原子性质相似 |
| D.L层电子数为奇数的原子和M层电子数为奇数的原子对应的元素一定都是主族元素 |
您最近一年使用:0次
2024-01-11更新
|
182次组卷
|
3卷引用:福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
10 . 一种由W、X、Y、Z、Q五种短周期主族元素组成的离子结构如图所示,其中X、Q同主族,Y的基态原子s轨道电子数是p轨道的2倍,且W、X、Z原子序数之和为15.下列说法正确的是
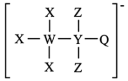
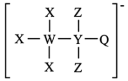
A.电负性: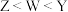 |
B.最高价氧化物对应水化物的酸性: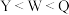 |
C.阴离子还原性: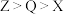 |
| D.X与Z形成的化合物沸点一定高于Y与Z形成的化合物沸点 |
您最近一年使用:0次



