1 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。 、Ⅱ
、Ⅱ 元素属于
元素属于___________ 区。
②2017年5月9日我国发布了113号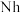 、115号
、115号 、117号
、117号 、118号
、118号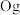 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期Ⅴ 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中“
的信息,其中“ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
②前四周期同族元素的某种性质 随核电荷数的变化趋势如图所示,则下列说法正确的是
随核电荷数的变化趋势如图所示,则下列说法正确的是___________ (填字母)。 、
、 、
、 表示氧族元素,则
表示氧族元素,则 表示对应氢化物的稳定性
表示对应氢化物的稳定性
B.若 、
、 、
、 表示卤族元素,则
表示卤族元素,则 表示对应简单离子的还原性
表示对应简单离子的还原性
C.若 、
、 、
、 表示第Ⅰ
表示第Ⅰ 族元素,则
族元素,则 表示对应离子的氧化性
表示对应离子的氧化性
D.若 、
、 、
、 表示第Ⅱ
表示第Ⅱ 族元素,则
族元素,则 表示最高价氧化物对应水化物的碱性
表示最高价氧化物对应水化物的碱性

 、Ⅱ
、Ⅱ 元素属于
元素属于②2017年5月9日我国发布了113号
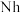 、115号
、115号 、117号
、117号 、118号
、118号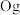 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期Ⅴ
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中“
的信息,其中“ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是②前四周期同族元素的某种性质
 随核电荷数的变化趋势如图所示,则下列说法正确的是
随核电荷数的变化趋势如图所示,则下列说法正确的是
 、
、 、
、 表示氧族元素,则
表示氧族元素,则 表示对应氢化物的稳定性
表示对应氢化物的稳定性B.若
 、
、 、
、 表示卤族元素,则
表示卤族元素,则 表示对应简单离子的还原性
表示对应简单离子的还原性C.若
 、
、 、
、 表示第Ⅰ
表示第Ⅰ 族元素,则
族元素,则 表示对应离子的氧化性
表示对应离子的氧化性D.若
 、
、 、
、 表示第Ⅱ
表示第Ⅱ 族元素,则
族元素,则 表示最高价氧化物对应水化物的碱性
表示最高价氧化物对应水化物的碱性
您最近半年使用:0次
名校
2 . 短周期主族元素W、X、Y和Z的原子序数依次增大,W原子是半径最小的原子,X原子的最外层电子数是内层电子数的3倍,元素Y是应用广泛的半导体材料,元素Z与X同主族。下列说法正确的是
| A.X、Y两种元素形成的化合物一定是共价化合物 |
| B.原子半径:Z>Y>X>W |
| C.最高价氧化物对应的水化物酸性:Y>Z |
| D.氢化物稳定性:X<Z |
您最近半年使用:0次
解题方法
3 . 主族元素W、X、Y、Z的原子序数依次增大,且均不大于20.元素W是整个宇宙中最常见的元素,现今太阳中大约75%是W元素; 是一种常见的助燃剂;Y是植物生长的营养元素;Y与X在不同周期.这四种元素形成的一种食品添加剂的结构如图所示.下列说法正确的是
是一种常见的助燃剂;Y是植物生长的营养元素;Y与X在不同周期.这四种元素形成的一种食品添加剂的结构如图所示.下列说法正确的是
 是一种常见的助燃剂;Y是植物生长的营养元素;Y与X在不同周期.这四种元素形成的一种食品添加剂的结构如图所示.下列说法正确的是
是一种常见的助燃剂;Y是植物生长的营养元素;Y与X在不同周期.这四种元素形成的一种食品添加剂的结构如图所示.下列说法正确的是
| A.保存Z的单质时,无须防潮 |
B.最简单氢化物的稳定性: |
| C.由W、X、Y三种元素形成的化合物均属于强酸 |
| D.W与X能形成既有极性键又有非极性键的化合物 |
您最近半年使用:0次
名校
解题方法
4 . 短周期元素X、Y、Z、W的原子序数依次增大。X的原子核外有1个电子,Y是地壳中含量最多的元素,Z位于元素周期表第ⅢA族,W单质可广泛用于生产芯片。下列说法正确的是
| A.原子半径:Y<Z<W | B.元素的非金属性:X<Y<W |
| C.W的简单氢化物比Y的稳定 | D.Z单质制成的容器可盛放冷浓硫酸 |
您最近半年使用:0次
名校
5 . 已知 四种主族元素,原子序数小于18且依次增大,
四种主族元素,原子序数小于18且依次增大, 元素的一种原子中不含中子,
元素的一种原子中不含中子, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 元素原子的最外层电子数为电子层数的
元素原子的最外层电子数为电子层数的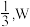 元素原子的最外层电子数比最内层多5个电子。下列说法正确的是
元素原子的最外层电子数比最内层多5个电子。下列说法正确的是
 四种主族元素,原子序数小于18且依次增大,
四种主族元素,原子序数小于18且依次增大, 元素的一种原子中不含中子,
元素的一种原子中不含中子, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 元素原子的最外层电子数为电子层数的
元素原子的最外层电子数为电子层数的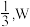 元素原子的最外层电子数比最内层多5个电子。下列说法正确的是
元素原子的最外层电子数比最内层多5个电子。下列说法正确的是A.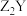 和 和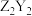 的阴、阳离子个数比相同 的阴、阳离子个数比相同 | B.电解 和 和 形成的饱和盐溶液可以制备 形成的饱和盐溶液可以制备 |
C. 与 与 形成的化合物只含有极性共价键 形成的化合物只含有极性共价键 | D.W元素最高价氧化物对应水化物为弱酸 |
您最近半年使用:0次
2024-03-14更新
|
47次组卷
|
2卷引用:2024年广西南宁、柳州等地示范性高中高一下学期3月开学考调研测试 化学试题
名校
解题方法
6 . 物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,实验室中常用 洗涤残留在试管壁上的N单质。下列说法错误的是
洗涤残留在试管壁上的N单质。下列说法错误的是
 洗涤残留在试管壁上的N单质。下列说法错误的是
洗涤残留在试管壁上的N单质。下列说法错误的是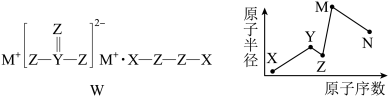
| A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应 |
B.实验室中用 洗涤残留在试管壁上的N单质,利用了N单质的还原性 洗涤残留在试管壁上的N单质,利用了N单质的还原性 |
| C.Z的氢化物的沸点不一定大于Y的氢化物的沸点 |
| D.化合物W常用作氧化剂,不宜在高温下使用 |
您最近半年使用:0次
2024-03-01更新
|
705次组卷
|
3卷引用:2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
名校
解题方法
7 . 元素周期表对化学的发展有很大影响,下表是元素周期表的一部分,数字①~⑩代表十种常见的短周期元素,请按题目要求回答下列问题:

(1)①在周期表中的位置为___________ 。
(2)写出②最高价氧化物的电子式___________ 。
(3)在②~⑤元素中,原子半径最大的是___________ (填化学符号)。
(4)比较④、⑤、⑥、⑦离子的半径大小___________ (用化学符号表示且用“>”连接)。
(5)以上这些元素中,最不活泼的金属元素是___________ (填化学符号,下同),这些元素的最高价氧化物对应的水化物中,碱性最强的是___________ ,呈两性的氢氧化物是___________ ,写出二者之间相互反应的化学方程式___________ 。
(6)⑥的金属性强于⑦,试用实验证明(简述简单操作、主要现象和结论)___________ 。用原子结构解释原因:二者在同一周期,核电荷数依次增多,___________ 失电子能力逐渐减弱,因此金属性逐渐减弱。
(7)砷( )是人体必需的微量元素,与③同一主族,
)是人体必需的微量元素,与③同一主族, 原子比③原子多两个电子层,则砷的原子结构示意图为
原子比③原子多两个电子层,则砷的原子结构示意图为___________ ,该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是___________ (用化学符号表示且用“>”连接)。

(1)①在周期表中的位置为
(2)写出②最高价氧化物的电子式
(3)在②~⑤元素中,原子半径最大的是
(4)比较④、⑤、⑥、⑦离子的半径大小
(5)以上这些元素中,最不活泼的金属元素是
(6)⑥的金属性强于⑦,试用实验证明(简述简单操作、主要现象和结论)
(7)砷(
 )是人体必需的微量元素,与③同一主族,
)是人体必需的微量元素,与③同一主族, 原子比③原子多两个电子层,则砷的原子结构示意图为
原子比③原子多两个电子层,则砷的原子结构示意图为
您最近半年使用:0次
8 . 短周期主族元素X、Y、Z、Q在元素周期表中的相对位置如图所示,已知X、Y、Q三种元素最外层电子数之和为17。则下列说法正确的是
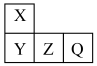
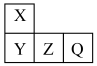
| A.Q的单质是一种黄绿色有毒气体 | B.Q元素只有负价,没有最高正价 |
C.原子半径: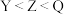 | D.X元素的最高价氧化物对应的水化物为中强酸 |
您最近半年使用:0次
解题方法
9 . 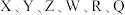 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q的价电子排布式为_______ 。
(2) 形成的有机物
形成的有机物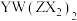 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为_____ , 离子的立体构型是
离子的立体构型是_________ 。
(3)Y、R的最高价氧化物的沸点较高的是_________ (填化学式),原因是_______ 。
(4)将Q单质的粉末加入 的浓溶液中,并通入
的浓溶液中,并通入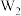 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为_________ 。
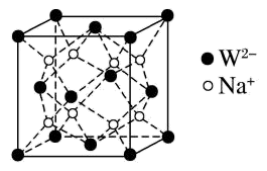
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________ (填化学式)。 的配位数为
的配位数为_______ ,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为________ 。已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为______ nm(用含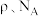 的计算式表示)。
的计算式表示)。
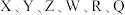 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:(1)Q的价电子排布式为
(2)
 形成的有机物
形成的有机物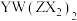 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为 离子的立体构型是
离子的立体构型是(3)Y、R的最高价氧化物的沸点较高的是
(4)将Q单质的粉末加入
 的浓溶液中,并通入
的浓溶液中,并通入 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为
 的配位数为
的配位数为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为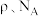 的计算式表示)。
的计算式表示)。
您最近半年使用:0次
名校
解题方法
10 . 短周期主族元素X、Y、Z、W、T原子序数依次增大,分占三个不同的周期,Y是地壳中含量最多的元素,Z原子的最外层只有一个电子,W位于元素周期表ⅢA族,T与Y属于同一主族元素。下列说法正确的是
| A.原子半径:r(T)>r(W)>r(Z) |
| B.Z的最高价氧化物对应的水化物的碱性比W的弱 |
| C.Y的简单气态氢化物的热稳定性比T的强 |
| D.Y、Z只能形成一种化合物 |
您最近半年使用:0次
2024-01-12更新
|
137次组卷
|
2卷引用:广西柳州市柳州高级中学2023-2024学年高一上学期期末考试化学试题



