名校
解题方法
1 . 某反应体系中反应物与生成物有:K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。根据上述信息回答下列问题:
(1)S原子核外电子共占据_______ 个能级,能量最高电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)充填气象观测气球时,可用CaH2与H2O反应制H2,反应的化学方程式为_______ 。CaH2、BaH2属于_______ 晶体,熔点CaH2_______ BaH2(填>、<、=),从物质结构角度解释原因_______ 。
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
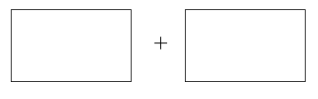
(5)已知CaC2O4在反应中失去电子,则该反应的氧化剂是_______ ,在标准状况下生成11.2L X时,有0.5mol电子转移,共消耗0.25mol CaC2O4,X的化学式为_______ 。将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:_______ 。
(1)S原子核外电子共占据
(2)下列说法正确的是_______。
| A.CaH2和CaO2中,阴阳离子个数比相同 |
| B.O原子与S原子核外电子的伸展方向都是4种 |
| C.H2SO4在该反应中的作用和实验室与亚硫酸钠反应制SO2时相同 |
| D.原子核外电子的能级数由少到多的顺序为:H<C<O<S |
(4)下列事实能说明C、S两元素非金属性强弱的是_______。
| A.同浓度Na2CO3和Na2SO4的pH | B.浓硫酸和碳酸的氧化性 |
| C.CH4和H2S的稳定性 | D.CS2中共用电子对的偏移 |

您最近半年使用:0次
2 . 根据表中短周期元素的信息判断下列说法错误的是
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(nm) | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.186 |
| 最高或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A.元素④的氧化物对应水化物的酸性强于元素⑤的氧化物对应水化物 |
| B.元素④气态氢化物的稳定性强于元素⑤气态氢化物 |
| C.元素⑥对应的简单离子半径小于元素⑦对应的简单离子半径 |
| D.元素②⑥形成的化合物具有两性 |
您最近半年使用:0次
3 . X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L−1;W的质子数是X、Y、Z、M四种元素质子数之和的 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.简单离子半径:W+>Y3->X2->M+ |
| B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性 |
| C.1molWM溶于足量水中完全反应,共转移2mol电子 |
| D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键 |
您最近半年使用:0次
2020-05-01更新
|
768次组卷
|
3卷引用:上海大学附属中学2021-2022学年学高三下学期第一次测试化学试题
2010·上海奉贤·二模
解题方法
4 . A、B、M、X、Z是周期表中的短周期元素。对它们的单质或部分化合物描述如下:
回答下列问题:
(1)B的最简氢化物的分子构型是__ ,A原子的最外层电子的轨道表示式为__ ;
(2)X在元素周期表中的位置为__ 周期__ 族,写出X的单质溶解在NaOH溶液中的离子方程式为__ ;
(3)A、B两元素非金属性较强的是__ (写元素符号)。写出证明这一结论的一个化学方程式__ ;
(4)与元素Z相比,元素M的最简氢化物稳定性__ (选填“强”、“弱”),理由是__ 。
| A | B | M | X | Z |
| 最简氢化物是含氢量最高的有机物 | 单质为气体,元素原子中成对电子数比未成对电子数多一个 | 最简氢化物的水溶液呈酸性 | 原子核外有5种能量不同的电子,最外层有3个电子 | 最高价氧化物对应的水化物为最强酸 |
(1)B的最简氢化物的分子构型是
(2)X在元素周期表中的位置为
(3)A、B两元素非金属性较强的是
(4)与元素Z相比,元素M的最简氢化物稳定性
您最近半年使用:0次
2011·上海黄浦·一模
解题方法
5 . 某元素M的原子核内质子数与中子数相等,它形成气态氢化物在标准状况下的密度是1.518g/L,该氢化物0.5mol充分燃烧,生成9g水,则M的元素符号为____ ,原子序数是_____ ,原子结构示意图为__________ ,M的阴离子电子层结构与____________ 等微粒相同。
您最近半年使用:0次
11-12高三上·上海长宁·期末
解题方法
6 . 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
您最近半年使用:0次
7 . 下表为元素周期表的一部分:
请填写下列空白:
(1)表中元素,原子半径最大的是___ (填元素符号);①的核外电子排布式___ ,④的M层上有___ 种不同能级的电子。③和⑥两元素形成化合物的电子式为___ 。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是___ (填化学式)。
(3)比较④、⑤两种元素的简单离子半径:___ (填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为___ 。
(4)列举一个事实来证明元素①比元素⑤的非金属性强___ 。
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式___ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是
(3)比较④、⑤两种元素的简单离子半径:
(4)列举一个事实来证明元素①比元素⑤的非金属性强
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式
您最近半年使用:0次
8 . 几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A.T、Q的氢化物常态下均为无色气体 |
| B.L、M的单质与稀盐酸反应速率:M > L |
| C.R的氧化物对应的水化物可能具有两性 |
| D.L、Q形成的简单离子核外电子数相等 |
您最近半年使用:0次
2020-03-23更新
|
57次组卷
|
2卷引用:上海市十二校2015届高三12月联考化学试题
14-15高三上·上海宝山·阶段练习
名校
解题方法
9 . 有X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如下变化,其中B和C均为10电子分子。下列说法中不正确的是


| A.X元素位于ⅥA | B.A能溶解于B中 |
| C.B的沸点大于C的沸点 | D.A和C不可能发生氧化还原反应 |
您最近半年使用:0次
10 . X、Y、Z、R 是四种原子序数依次递增的短周期主族元素,X 原子最外层有两个未成对电子,Y原子最外层电子数是内层电子数的3倍,Z元素的单质常温下能与水剧烈反应产生氢气,R原子的核外电子数 是X原子与 Z 原子的核外电子数之和。下列叙述正确的是( )
| A.原子半径的大小顺序:X<Y<Z<R |
| B.X、Y 分别与氢元素组成的化合物熔沸点一定是:X<Y |
| C.最高价氧化物对应水化物的酸性:R>X |
| D.Y与Z形成的两种化合物中的化学键和晶体类型均完全相同 |
您最近半年使用:0次
2019-12-30更新
|
213次组卷
|
3卷引用:2019届上海奉贤区高考第一次模拟化学试题



