名校
解题方法
1 . A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________ ,B________ ,C________ ,D________ ,E________ 。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________ (用化学式表示)
(3)画出D的离子结构示意图________ 。
(4)用一个方程式证明B、E的非金属性的强弱_______________ 。
(5)写出E的最高价氧化物的一种用途:_________ 。
(6)由这五种元素组成的三核10电子的分子为________ ,四核10电子的分子是________ 。由这五种元素组成的四核18电子的分子为________ ,五核18电子的分子是________ 。
(1)写出它们的元素符号:A
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为
(3)画出D的离子结构示意图
(4)用一个方程式证明B、E的非金属性的强弱
(5)写出E的最高价氧化物的一种用途:
(6)由这五种元素组成的三核10电子的分子为
您最近半年使用:0次
2020-03-05更新
|
89次组卷
|
2卷引用:山东省潍坊市潍坊中学2019-2020学年下学期高一2月月考化学试题
2 . 现四种短周期元素的有关信息如表所示:
则甲、乙、丙、丁四种元素的原子序数从大到小的排列顺序为( )。
| 元素 | 结构特点及在周期表中的位置 | 单质及化合物的部分性质与用途 |
| 甲 | 在元素周期表中,主族序数等于周期序数 | 工业上用电解法冶炼该金属 |
| 乙 | 原子最外层电子数是次外层电子数的一半 | 氧化物是工业制普通玻璃的主要原料 |
| 丙 | 原子最外层电子数是最内层电子数的2倍 | 单质存在多种同素异形体 |
| 丁 | 元素能形成两种不同的单质 | 丁的一种单质与 溶液反应生成丁的另一种单质 溶液反应生成丁的另一种单质 |
| A.甲、乙、丙、丁 | B.丁、甲、乙、丙 |
| C.丙、丁、甲、乙 | D.乙、甲、丁、丙 |
您最近半年使用:0次
名校
3 . 已知某元素A能与ⅦA族某一元素B生成A的最高价化合物X,在化合物X中B的含量为92.2%,而在与此相应的A的氧化物Y中,氧的含量为72.7%。A与B生成的化合物X为一无色透明液体,沸点77℃,对氢气的相对密度为77。
回答下列问题(不必给出计算过程):
(1)A元素名称___ ,并指出属于第几周期第几族___ ;
(2)X的分子式___ ,分子空间构型和键角___ 、___ ;
(3)Y的分子式___ ,分子空间构型和键角___ 、___ ;
(4)列举化合物X的两种用途___ 。
回答下列问题(不必给出计算过程):
(1)A元素名称
(2)X的分子式
(3)Y的分子式
(4)列举化合物X的两种用途
您最近半年使用:0次
4 . X、Y、Z、W四种常见元素,其中X\、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:
回答下列问题:
(1)W在周期表的位置为_________ ,W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为_________________________________________ 。
(2)X的简单阴离子的结构示意图为___________________ ;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为____________________________ 。
(3)Z的氧化物在通讯领域的用途是___________________ ,工业上制备Z的单质的化学反应方程式为 ___________________________________ 。
(4)YX3固体在熔融状态下不导电,则YX3固体中存在__________ 键;在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能有________ 种情况。
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的 | Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为
(2)X的简单阴离子的结构示意图为
(3)Z的氧化物在通讯领域的用途是
(4)YX3固体在熔融状态下不导电,则YX3固体中存在
您最近半年使用:0次
名校
解题方法
5 . A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,w的合金用量最大、用途最广。
回答下列问题:
(1)D在元素周期表中的位置是______________________ 。
(2)A分别形成与C、E形成的最简单化合物中沸点较高的是___________________ (填化学式),原因是________________________ 。
(3)A、C、D三种元素形成的物质中含有的化学键类型是________________________ 。
(4)灼热的炭能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为____________ 。
(5)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________ 。
回答下列问题:
(1)D在元素周期表中的位置是
(2)A分别形成与C、E形成的最简单化合物中沸点较高的是
(3)A、C、D三种元素形成的物质中含有的化学键类型是
(4)灼热的炭能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为
(5)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近半年使用:0次
2017-04-26更新
|
417次组卷
|
2卷引用:重庆市九校2016-2017学年高一下学期联考化学试题
13-14高三·全国·课时练习
解题方法
6 . A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为双原子分子。回答问题:
(1)D元素的名称为______ , F形成的离子的结构示意图为______ 。
(2)写出液态化合物Y的一种用途______ 。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式______ ,使用这种气球存在的隐患是______ 。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:______ 。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为______ 。
(1)D元素的名称为
(2)写出液态化合物Y的一种用途
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为
您最近半年使用:0次
10-11高三·山西太原·阶段练习
7 . 元素X、Y、Z、W为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+的离子半径逐渐减小,化合物XW在常温下为气体。请填空:
(1)元素Y在周期表中的位置是_______ ,化合物Z2Y2中阴阳离子个数比为_______ 。
(2)A、B均为由上述四种元素中的三种组成的强电解质,且两种物质中,组成元素的原子数目比均为1:1:1.A溶液中水的电离程度比B溶液中水的电离程度小,则A的化学式是_______ ,B的名称是_______ 。
(3)用B物质可以在碱性环境下处理含CN-的废水,将CN-氧化成 和N2,写出该反应的离子方程式:
和N2,写出该反应的离子方程式:_______ 。
(4)X、Z形成的化合物ZX在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的Z元素的化合物。写出它与乙醇反应的化学方程式:_______ 。
(1)元素Y在周期表中的位置是
(2)A、B均为由上述四种元素中的三种组成的强电解质,且两种物质中,组成元素的原子数目比均为1:1:1.A溶液中水的电离程度比B溶液中水的电离程度小,则A的化学式是
(3)用B物质可以在碱性环境下处理含CN-的废水,将CN-氧化成
 和N2,写出该反应的离子方程式:
和N2,写出该反应的离子方程式:(4)X、Z形成的化合物ZX在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的Z元素的化合物。写出它与乙醇反应的化学方程式:
您最近半年使用:0次
2011·河北唐山·一模
解题方法
8 . A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:
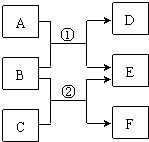
Ⅰ若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源。
(1)写出反应①的化学方程式_______________________________________________ 。
(2)用化学方程式表示E在冶金工业上的一种重要用途____________________________________ 。
Ⅱ若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的电子式____________ 。
(2)由A或C转化为E,每消耗1molB,转移电子的物质的量为_______ mol。
(3)同温同压下,将V1L A气体和V2L E气体通入水中,
①若所得溶液的pH=7,则V1_____ V2(填“>”或“<”或“=”)。
②若V1=2V2,反应后溶液中各离子浓度由大到小的顺序为_______________________ 。

Ⅰ若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源。
(1)写出反应①的化学方程式
(2)用化学方程式表示E在冶金工业上的一种重要用途
Ⅱ若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的电子式
(2)由A或C转化为E,每消耗1molB,转移电子的物质的量为
(3)同温同压下,将V1L A气体和V2L E气体通入水中,
①若所得溶液的pH=7,则V1
②若V1=2V2,反应后溶液中各离子浓度由大到小的顺序为
您最近半年使用:0次
2011·江西·二模
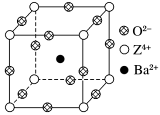
9 . 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
(1) Y在周期表中位于______________ ;Z4+的核外电子排布式为___________________ 。
(2)X的该种氢化物分子构型为________ ,X在该氢化物中以_______ 方式杂化。X和Y形成的化合物的熔点应该_______ (填“高于”或“低于”)X的氢化物的熔点。
(3)①制备M的化学方程式是_____________ 。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________ 。
③在M晶体中,Z4+的氧配位数为________ 。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。

(1) Y在周期表中位于
(2)X的该种氢化物分子构型为
(3)①制备M的化学方程式是
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的
③在M晶体中,Z4+的氧配位数为
④已知O2-半径为1.40×10-10 m,则Z4+半径为
您最近半年使用:0次
2016-12-09更新
|
1121次组卷
|
5卷引用:2011届江西省重点中学协作体高三第二次联考(理综)化学部分
(已下线)2011届江西省重点中学协作体高三第二次联考(理综)化学部分苏教版2017届高三单元精练检测十一化学试题黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题山东省章丘市第四中学2019届高三上学期第二次质量检测理综化学试题新疆奎屯市第一高级中学2018-2019学年高二下学期第一次月考化学试题
2010·江西·三模
解题方法
10 . A、B、C、D、E五种短周期元素,原子序数依次递增,A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,而E在同周期元素中原子半径最小。A、C、D三种元素可形成化合物甲,B、C、D三种元素可形成化合物乙,甲和乙均为中学化学常见物质。请回答:
(1)甲的电子式为_____________ ,其中所含化学键类型为________________ 。
(2)A的单质与C的单质在碱性条件下构成燃料电池,其正极反应式为__________ ;负极反应式___________ 为。
(3)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH—的物质的量浓度c(OH—)甲:c(OH—)乙=______________ .
(4)A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出的一种用途_________ ;
写出A2C2与E的单质反应的化学方程式____________ 。
(5)浓氨水与固体甲混合,可用于快速制取少量氨气,其原因是___________________________________________________ (请用必要的方程式和简要的文字加以说明)。
(1)甲的电子式为
(2)A的单质与C的单质在碱性条件下构成燃料电池,其正极反应式为
(3)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH—的物质的量浓度c(OH—)甲:c(OH—)乙=
(4)A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出的一种用途
写出A2C2与E的单质反应的化学方程式
(5)浓氨水与固体甲混合,可用于快速制取少量氨气,其原因是
您最近半年使用:0次



