1 . 研究表明不含结晶水的X(由4种短周期元素组成),可作为氧化剂和漂白剂,被广泛应用于蓄电池工业等。为探究X的组成和性质,设计并完成了下列实验:
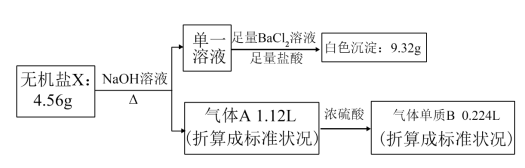
已知:气体单质B可使带火星的木条复燃。
(1)A中所含气体的分子式:_______ ,X中含有的元素为_______ 。
(2)请写出检验X中阳离子的方法:_______ 。
(3)已知X常用于检验 ,它可将
,它可将 氧化成
氧化成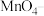 。请写出X溶液和少量
。请写出X溶液和少量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。

已知:气体单质B可使带火星的木条复燃。
(1)A中所含气体的分子式:
(2)请写出检验X中阳离子的方法:
(3)已知X常用于检验
 ,它可将
,它可将 氧化成
氧化成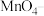 。请写出X溶液和少量
。请写出X溶液和少量 溶液反应的离子方程式:
溶液反应的离子方程式:
您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F六种元素,原子序数依次增大,A是周期表中原子半径最小的元素,B原子的最外层上有4个电子;D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体,F的L层电子数等于K、M两个电子层上的电子数之和。(用元素符号或化学式 填空回答以下问题)
(1)C元素在周期表中的位置_______ 。
(2)B、D两元素形成化合物属于(“离子”或“共价”)_______ 化合物。
(3)F原子结构示意图为_______ 。
(4)写出E2D2与BD2反应的化学方程式:_______ 。
(5)B、C、D的最简单氢化物稳定性由强到弱依次为:_______ 。(填化学式)
(6)写出F元素的最高价氧化物的水化物和B反应的化学方程式:_______ 。
(1)C元素在周期表中的位置
(2)B、D两元素形成化合物属于(“离子”或“共价”)
(3)F原子结构示意图为
(4)写出E2D2与BD2反应的化学方程式:
(5)B、C、D的最简单氢化物稳定性由强到弱依次为:
(6)写出F元素的最高价氧化物的水化物和B反应的化学方程式:
您最近一年使用:0次
2021-10-09更新
|
154次组卷
|
2卷引用:甘肃省庆阳市第六中学2020-2021学年高二下学期期末考试化学试题
3 . 随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。
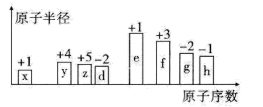
请回答下列问题:
(1)d的简单氢化物的沸点比同主族相邻元素的氢化物沸点___________ (填“高”或“低”),原因是:___________ ;x与e形成的化合物电子式为___________
(2)比较g、h常见离子的半径大小:___________ (填化学式,下同);比较e、f的最高价氧化物对应水化物的碱性强弱:___________ 。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶1∶1∶3,其化学式为___________ 。
②能形成共价化合物,写出其中一种的结构简式___________ 。

请回答下列问题:
(1)d的简单氢化物的沸点比同主族相邻元素的氢化物沸点
(2)比较g、h常见离子的半径大小:
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶1∶1∶3,其化学式为
②能形成共价化合物,写出其中一种的结构简式
您最近一年使用:0次
14-15高二上·上海杨浦·期末
名校
4 .  、
、 、
、 是三种处在不同短周期元素,原子序数依次减小,三种元素可组成化合物AxByCz,已知:
是三种处在不同短周期元素,原子序数依次减小,三种元素可组成化合物AxByCz,已知:
(1) 、
、 、
、 均为正整数且
均为正整数且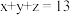 ;
;
(2)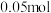 该化合物与过量水反应生成
该化合物与过量水反应生成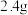 气体
气体 ,同时生成
,同时生成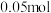 的白色沉淀
的白色沉淀 ,
, 既能溶于盐酸又能溶于氢氧化钠溶液;
既能溶于盐酸又能溶于氢氧化钠溶液;
(3)同温同压下 由
由 、
、 组成的气体
组成的气体 完全燃烧时,需要
完全燃烧时,需要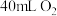 ,燃烧产物是
,燃烧产物是 和
和 。由此可知:三种元素分别是
。由此可知:三种元素分别是
__________ 
__________ 
__________ 。气体 的电子式为
的电子式为____________________ ,AxByCz的分子式__________ 。
 、
、 、
、 是三种处在不同短周期元素,原子序数依次减小,三种元素可组成化合物AxByCz,已知:
是三种处在不同短周期元素,原子序数依次减小,三种元素可组成化合物AxByCz,已知:(1)
 、
、 、
、 均为正整数且
均为正整数且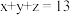 ;
;(2)
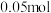 该化合物与过量水反应生成
该化合物与过量水反应生成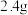 气体
气体 ,同时生成
,同时生成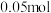 的白色沉淀
的白色沉淀 ,
, 既能溶于盐酸又能溶于氢氧化钠溶液;
既能溶于盐酸又能溶于氢氧化钠溶液;(3)同温同压下
 由
由 、
、 组成的气体
组成的气体 完全燃烧时,需要
完全燃烧时,需要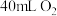 ,燃烧产物是
,燃烧产物是 和
和 。由此可知:三种元素分别是
。由此可知:三种元素分别是


 的电子式为
的电子式为
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
5 . 由两种元素组成的化合物X,是现代工业的重要原料。为探究X的组成,设计并进行如下实验:
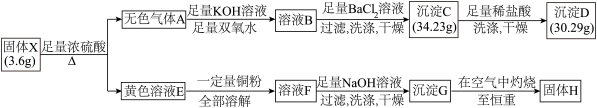
(1)将黄色溶液E稀释后通入无色气体A,发生反应的离子方程式为______________ 。
(2)除 外,溶液F中一定含有的金属阳离子为
外,溶液F中一定含有的金属阳离子为________ ,其检验方法为______________ 。
(3)固体X与浓硫酸反应的化学方程式是_________________ 。
(4)若测得固体H的质量为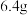 ,则溶液E溶解的铜粉质量为
,则溶液E溶解的铜粉质量为________ 。

(1)将黄色溶液E稀释后通入无色气体A,发生反应的离子方程式为
(2)除
 外,溶液F中一定含有的金属阳离子为
外,溶液F中一定含有的金属阳离子为(3)固体X与浓硫酸反应的化学方程式是
(4)若测得固体H的质量为
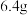 ,则溶液E溶解的铜粉质量为
,则溶液E溶解的铜粉质量为
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D四种短周期元素,原子序数依次递增,A原子形成的阳离子就是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大。A、C、D三种元素可形成化合物甲,B、C、D三种元素可形成化合物乙,甲与乙均为中学化学常见物质。请回答:
(1)乙的化学式为___________ ,其水溶液呈碱性的原因为_____________________ (用离子方程式表示)。
(2)将3g B的单质在足量C的单质中燃烧,可放出98.4kJ的热量,该反应的热化学方程式为:________________ 。
(3)常温下,甲与乙的水溶液pH均为9,则这两种溶液中由水电离出的OH-的物质的量浓度c(OH-)甲:c(OH-)乙=_______________ 。
(1)乙的化学式为
(2)将3g B的单质在足量C的单质中燃烧,可放出98.4kJ的热量,该反应的热化学方程式为:
(3)常温下,甲与乙的水溶液pH均为9,则这两种溶液中由水电离出的OH-的物质的量浓度c(OH-)甲:c(OH-)乙=
您最近一年使用:0次
7 . 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
回答下列问题:
(1)上述元素中②元素的名称_______ ;⑤元素在周期表中的位置是________ 。
(2)在③、⑦、⑧的气态氢化物中最稳定的是_____ (用化学式表示);⑦的最高价氧化物对应水化物的化学式是________ 。
(3)写出⑥的单质和④的最高价氧化物对应水化物的化学方程式是________ 。
(4)④、⑤是两种活泼性不同的金属,用事实来说明④比⑤活泼性更强________ 。
(5)由①和⑧组成的化合物极易溶于水,请设计简单的实验加以说明。写出简要的实验操作、现象和结论。__________________________ 。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | V A | Ⅵ A | Ⅶ A | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中②元素的名称
(2)在③、⑦、⑧的气态氢化物中最稳定的是
(3)写出⑥的单质和④的最高价氧化物对应水化物的化学方程式是
(4)④、⑤是两种活泼性不同的金属,用事实来说明④比⑤活泼性更强
(5)由①和⑧组成的化合物极易溶于水,请设计简单的实验加以说明。写出简要的实验操作、现象和结论。
您最近一年使用:0次
解题方法
8 . A,B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A,B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电。试回答下列问题:
(1)A,B的元素符号分别是________ 、________ 。
(2)用电子式表示A,B元素形成化合物的过程___________________________________________________ 。
(3)A,B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________ 个阴离子;晶体中阴、阳离子数之比为________ 。
(4)A,B所形成化合物的晶体的熔点比NaF晶体的熔点________ ,其判断的理由是
________________________________________________________________________ 。
(1)A,B的元素符号分别是
(2)用电子式表示A,B元素形成化合物的过程
(3)A,B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了
(4)A,B所形成化合物的晶体的熔点比NaF晶体的熔点
您最近一年使用:0次
2019-02-26更新
|
162次组卷
|
2卷引用:云南省玉溪市江川区第二中学2018-2019学年高二上学期期末考试化学试题
名校
解题方法
9 . 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
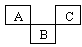
(1)写出元素符号:A____ ;C_____ 。
(2)B的最高价氧化物对应水化物的化学式为____ 。
(3)A的单质的电子式为___ ;A的氢化物的水溶液与其最高价氧化物的水化物反应的化学方程式____ 。

(1)写出元素符号:A
(2)B的最高价氧化物对应水化物的化学式为
(3)A的单质的电子式为
您最近一年使用:0次
2017-07-13更新
|
278次组卷
|
3卷引用:贵州省思南中学2018-2019学年高二下学期期末考试化学试题
解题方法
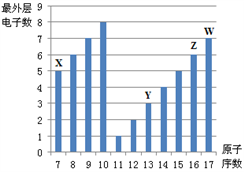
10 . 下图是部分短周期元素最外层电子数与原子序数的关系图。
请回答下列问题:
(1)画出Z的原子结构示意图__________________ 。
(2)原子半径:Y____ Z(填“>”、“<”)。
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为_________ 。
(4)X的最高价氧化物的水化物的化学式为_________ 。
(5)画出W的氢化物的电子式____________ 。
请回答下列问题:
(1)画出Z的原子结构示意图
(2)原子半径:Y
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为
(4)X的最高价氧化物的水化物的化学式为
(5)画出W的氢化物的电子式
您最近一年使用:0次



