解题方法
1 . A、B、C、D、E、F六种元素,原子序数依次增大,A是周期表中原子半径最小的元素,B原子的最外层上有4个电子;D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体,F的L层电子数等于K、M两个电子层上的电子数之和。(用元素符号或化学式 填空回答以下问题)
(1)C元素在周期表中的位置_______ 。
(2)B、D两元素形成化合物属于(“离子”或“共价”)_______ 化合物。
(3)F原子结构示意图为_______ 。
(4)写出E2D2与BD2反应的化学方程式:_______ 。
(5)B、C、D的最简单氢化物稳定性由强到弱依次为:_______ 。(填化学式)
(6)写出F元素的最高价氧化物的水化物和B反应的化学方程式:_______ 。
(1)C元素在周期表中的位置
(2)B、D两元素形成化合物属于(“离子”或“共价”)
(3)F原子结构示意图为
(4)写出E2D2与BD2反应的化学方程式:
(5)B、C、D的最简单氢化物稳定性由强到弱依次为:
(6)写出F元素的最高价氧化物的水化物和B反应的化学方程式:
您最近一年使用:0次
2021-10-09更新
|
154次组卷
|
2卷引用:甘肃省庆阳市第六中学2020-2021学年高二下学期期末考试化学试题
2 . 随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。
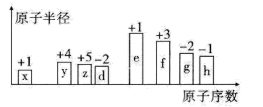
请回答下列问题:
(1)d的简单氢化物的沸点比同主族相邻元素的氢化物沸点___________ (填“高”或“低”),原因是:___________ ;x与e形成的化合物电子式为___________
(2)比较g、h常见离子的半径大小:___________ (填化学式,下同);比较e、f的最高价氧化物对应水化物的碱性强弱:___________ 。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶1∶1∶3,其化学式为___________ 。
②能形成共价化合物,写出其中一种的结构简式___________ 。

请回答下列问题:
(1)d的简单氢化物的沸点比同主族相邻元素的氢化物沸点
(2)比较g、h常见离子的半径大小:
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶1∶1∶3,其化学式为
②能形成共价化合物,写出其中一种的结构简式
您最近一年使用:0次
名校
3 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外电子层的p能级处于半充满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___________ 。
(2)用轨道表示式表示F元素原子的价电子排布:___________ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___________ (填化学式)。
(4)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___________ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:___________ 。
(1)E元素基态原子的电子排布式为
(2)用轨道表示式表示F元素原子的价电子排布:
(3)F、G元素对应的最高价含氧酸中酸性较强的是
(4)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
您最近一年使用:0次
4 . 已知 A、B、C、D、E五种元素中,原子序数依次增大,其中A、B、C、D为短周期元素。请根据下表中的信息回答有关问题:
(1)写出B基态原子的核外电子排布式____________________ .
(2)写出D原子价电子的轨道表示式为____________________ .
(3)E元素位于第______ 周期________ 族。
(4)写出A2B2的电子式___________ .
(5)写出C与D形成的化合物的化学式:_______________ 。
| 元素 | 结构或性质信息 |
| A | 原子半径最小的元素 |
| B | 原子最外能层的p能级中有一个轨道充填了2个电子。 |
| C | 原子的第一至第四电离能分别是:I1=841kJ/mol I2 = 1637 kJ/mol I3 = 3577kJ/mol I4 = 18540kJ/mol |
| D | 基态原子的核外电子共有17种运动状态 |
| E | 元素的价电子排布式为(n-l)dn+6ns2。 |
(2)写出D原子价电子的轨道表示式为
(3)E元素位于第
(4)写出A2B2的电子式
(5)写出C与D形成的化合物的化学式:
您最近一年使用:0次
2021-05-15更新
|
321次组卷
|
2卷引用:福建省宁德市高中同心顺联盟校2020-2021学年高二下学期期中考试化学试题
20-21高二·全国·单元测试
5 . X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第_______ 周期第_______ 族;W的原子半径比X的_______ (填“大”或“小”)。
(2)Z的第一电离能比W的_______ (填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是_______ ;氢、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称_______ 。
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)Z的第一电离能比W的
您最近一年使用:0次
名校
解题方法
6 . 有三种物质AC2(气体)、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)AC2、AD4的化学式分别为______ 、______ 。
(2)AD4分子其中含有的σ键类型为_______ (填“s-s σ键”“s-p σ键”或“p-p σ键”)。
(3)D的负一价阴离子的电子排布式为_________ ,B2C2的电子式为__________ ,属___________ (填“离子化合物”或“共价化合物”)。
(4)写出一种与AC互为等电子体的分子______________
(1)AC2、AD4的化学式分别为
(2)AD4分子其中含有的σ键类型为
(3)D的负一价阴离子的电子排布式为
(4)写出一种与AC互为等电子体的分子
您最近一年使用:0次
2019-04-22更新
|
82次组卷
|
3卷引用:贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题
名校
7 . A、B、C、D 是同一周期的四种元素。A、B、C 的原子序数依次相差为 1,A 元素的单质的化学性质活泼,A元素的原子在本周期中第一电离能最小。B 元素的氧化物 2.0g 恰好跟100mL0.5mol·L−1硫酸完全反应。B 元素单质跟D元素单质反应生成化合物BD2。根据以上事实,填写下列空白:
(1)A的原子结构示意图:_____ ,C原子的电子式为_____ ;
(2)BD2的电子式为_____ ;若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。这一反应的离子方程式是_________ 。
(1)A的原子结构示意图:
(2)BD2的电子式为
您最近一年使用:0次
2018-04-20更新
|
62次组卷
|
2卷引用:山西省柳林县2020--2021学年高二下学期期中考试化学试题
解题方法
8 . 已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是__________ ;从轨道重叠的方式看,B分子中的共价键类型有__________ 。
(2)写出②中反应的化学方程式:___________________________________________ 。
(3)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式:_________________________________________________ 。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是
(2)写出②中反应的化学方程式:
(3)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式:
您最近一年使用:0次
2018-02-15更新
|
106次组卷
|
2卷引用:山西省太原市第五十六中学校2020-2021学年高二第一次月考化学试题
名校
9 . 如表是元素周期表的一部分,针对表中的①~⑩元素,回答下列问题:
(1)在这些元素中,非金属性最强的元素符号是______ ;
(2)⑧元素的氢化物的化学式为___________ ;
(3)金属性最活泼的元素的原子结构示意图为______________ ;
(4)能用来雕刻玻璃的氢化物的化学式是__________ ;
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为__________ (用元素符号表示);
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式_________________________ ;
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是_________ (用化学式表示);
(8)能证明元素⑩比元素⑨的非金属性强的事实是_____ (填序号).
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)⑧元素的氢化物的化学式为
(3)金属性最活泼的元素的原子结构示意图为
(4)能用来雕刻玻璃的氢化物的化学式是
(5)④、⑨、⑩三种元素的原子半径由大到小的排列顺序为
(6)写出③元素的气态氢化物和⑨元素的最高价氧化物对应水化物相互反应的化学方程式
(7)在⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是
(8)能证明元素⑩比元素⑨的非金属性强的事实是
A.常温下⑩单质的密度小于⑨单质的密度
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈
D.⑨元素的最高价氧化物对应的水化物酸性强于⑩元素的最高价氧化物对应的水化物.
您最近一年使用:0次
2016-12-09更新
|
495次组卷
|
2卷引用:福建省龙岩市武平县第一中学2020-2021学年高二下学期开学考试化学试题



