名校
1 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的元素周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构。性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
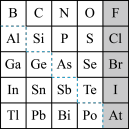
(1) 的结构示意图是
的结构示意图是___________ 。
(2)元素In在元素周期表中的位置是___________ 。
(3)P的最高价氧化物的化学式为___________ ,Al元素的最高价氧化物对应的水化物与S元素的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(4)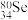 的中子数与电子数的差值是
的中子数与电子数的差值是___________ ;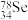 和
和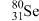 的物理性质
的物理性质___________ (填“相同”或“不同”),化学性质___________ (填“相同”或“不同”)。
(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是___________ 。
A.
B.
C.
②氢化物的还原性:
___________  (填“>”或“<”)。
(填“>”或“<”)。

(1)
 的结构示意图是
的结构示意图是(2)元素In在元素周期表中的位置是
(3)P的最高价氧化物的化学式为
(4)
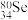 的中子数与电子数的差值是
的中子数与电子数的差值是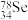 和
和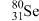 的物理性质
的物理性质(5)根据元素周期律及事实推断:
①在溶液中下列反应能发生的是
A.

B.

C.

②氢化物的还原性:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
解题方法
2 . 元素周期表是发现新元素的强有力手段。
Ⅰ.俄罗斯科学家联合小组宣布合成出第116号元素𫟷(Lv)的一种同位素,𫟷原子的质量数是293。
(1)𫟷元素在元素周期表中的位置为______ ,钲原子的核内中子数为______ 。
(2)𫟷元素与硫元素相比,非金属性更强的是______ (填元素符号)。
Ⅱ.下图为元素周期表的一部分,列出了10种元素在元素周期表中的位置:
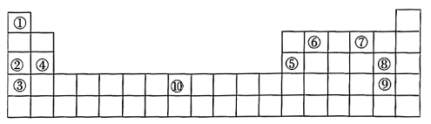
(3)②③④三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是____________ (填化学式)。
(4)⑤⑦⑧三种元素中,离子半径最小的是______ (填离子符号)。
(5)元素②和⑤的最高价氧化物对应的水化物相互反应的离子方程式为____________ 。
(6)元素⑩的单质与元素⑦的最简单氢化物在高温下反应的化学方程式为____________ 。
Ⅰ.俄罗斯科学家联合小组宣布合成出第116号元素𫟷(Lv)的一种同位素,𫟷原子的质量数是293。
(1)𫟷元素在元素周期表中的位置为
(2)𫟷元素与硫元素相比,非金属性更强的是
Ⅱ.下图为元素周期表的一部分,列出了10种元素在元素周期表中的位置:

(3)②③④三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是
(4)⑤⑦⑧三种元素中,离子半径最小的是
(5)元素②和⑤的最高价氧化物对应的水化物相互反应的离子方程式为
(6)元素⑩的单质与元素⑦的最简单氢化物在高温下反应的化学方程式为
您最近一年使用:0次
名校
3 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子_______ 、_______ 。
(3)有以下几种粒子: 、
、 、
、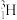 、
、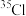 、
、 、
、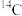 、
、 。其中含有
。其中含有_______ 种核素,互为同位素的有_______ 。由 、
、 、
、 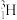 与
与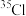 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有_______ 种。
(4)以下说法正确的是_______。
(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子
(3)有以下几种粒子:
 、
、 、
、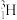 、
、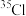 、
、 、
、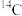 、
、 。其中含有
。其中含有 、
、 、
、 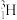 与
与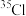 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有(4)以下说法正确的是_______。
| A.碱金属单质和卤素单质随着核电荷数的增加,熔沸点依次升高,密度依次增大 |
| B.由于F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性及热稳定性依次减弱 |
| C.第85号元素砹At是核电荷数最大的卤素,其单质At2可能是一种有色固体,难溶于水易溶于有机溶剂 |
| D.在新制氯水中加入少量铁粉,发生2Fe+3Cl2=2FeCl3 |
您最近一年使用:0次
名校
4 . Ⅰ.为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家为化学元素代言,我国有8位化学家成为硫(S)等元素的代言人。回答下列问题:
(1)下列有关性质的比较,能用元素周期律解释的是__ (填字母序号)
a.非金属性:O>S b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(2)Se与S位于同一主族,二者氢化物中稳定性较强的是:__ (用化学式表示)
(3)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
能够说明硫元素由+4价转化为+6价的证据(现象)是___ 。
Ⅱ.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力,2016年IUPAC确认了4种新元素,其中一种为115号元素锁(Mc),它与氮(N)、磷(P)为同族元素。回答下列问题:
(1)Mc元素在周期表中的位置为__ ;Mc元素的一种核素X可由反应 Am+
Am+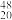 Ca→X+3
Ca→X+3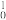 n得到,X原子核内的中子数为
n得到,X原子核内的中子数为__ 。
(2)下列性质的比较中,不能说明N的非金属性强于P的是__ (填序号)。
A.熔沸点:N2<P4(白磷)
B.稳定性:NH3(g)>PH3(g)
C.酸性:HNO3>H3PO4
(1)下列有关性质的比较,能用元素周期律解释的是
a.非金属性:O>S b.离子半径:S2->Cl-
c.酸性:H2SO4>H2SO3 d.酸性:H2SO4>H3PO4
(2)Se与S位于同一主族,二者氢化物中稳定性较强的是:
(3)某同学用如下装置探究不同价态硫元素之间的转化。培养皿中A、B、C三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加70%硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。
| 实验装置 | 瓶盖 | 物质 | 实验现象 |
 | A | 蘸有品红溶液的棉花 | 品红溶液褪色 |
| B | HCl、BaCl2的混合溶液 | 无明显变化 | |
| C | HCl、BaCl2、FeCl3的混合溶液 | 产生白色沉淀 |
能够说明硫元素由+4价转化为+6价的证据(现象)是
Ⅱ.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力,2016年IUPAC确认了4种新元素,其中一种为115号元素锁(Mc),它与氮(N)、磷(P)为同族元素。回答下列问题:
(1)Mc元素在周期表中的位置为
 Am+
Am+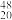 Ca→X+3
Ca→X+3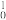 n得到,X原子核内的中子数为
n得到,X原子核内的中子数为(2)下列性质的比较中,不能说明N的非金属性强于P的是
A.熔沸点:N2<P4(白磷)
B.稳定性:NH3(g)>PH3(g)
C.酸性:HNO3>H3PO4
您最近一年使用:0次
5 . 请按要求填空:
(1)简单原子的原子结构如图:
①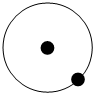 ②
② ③
③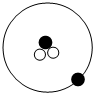
其中“●”表示质子或电子,“○”表示中子。则下列有关①②③的叙述正确的是___________(填标号)。
(2)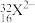 的质子数为
的质子数为___________ ,中子数为___________ ,电子数为___________ ,该元素在元素周期表中的位置是第___________ 周期___________ 族,该元素的最高价氧化物对应水化物的化学式是___________
(3)1828年,德国化学家维勒通过蒸发氰酸铵( )水溶液得到尿素[
)水溶液得到尿素[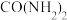 ]。
]。
①氰酸铵和尿素之间的关系是___________ (填标号)。
A.同位素B.同素异形体C.同分异构体D.同系物
②尿素在尿素酶的作用下能够水解生成碳酸铵,该反应的化学方程式为___________ 。
③现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,该反应的化学方程式为___________ 。
(1)简单原子的原子结构如图:
①
 ②
② ③
③
其中“●”表示质子或电子,“○”表示中子。则下列有关①②③的叙述正确的是___________(填标号)。
| A.①②③是三种不同的核素 | B.①②③具有相同的质量数 |
| C.①②③互为同位素 | D.①②③是三种化学性质不同的粒子 |
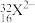 的质子数为
的质子数为(3)1828年,德国化学家维勒通过蒸发氰酸铵(
 )水溶液得到尿素[
)水溶液得到尿素[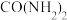 ]。
]。①氰酸铵和尿素之间的关系是
A.同位素B.同素异形体C.同分异构体D.同系物
②尿素在尿素酶的作用下能够水解生成碳酸铵,该反应的化学方程式为
③现代工业上用氨和二氧化碳在200个大气压和180℃时反应合成尿素,该反应的化学方程式为
您最近一年使用:0次
6 . 下表是部分短周期元素的信息,用化学用语回答下列问题。
(1)元素A在元素周期表中的位置为________ 。B的某种核素中中子数比质子数多1,则表示该核素的原子符号为_________________ 。
(2)写出钙与M原子个数比为1:2的化合物的电子式______________ 其中含有的化学键类型为__________ (填离子键、极性键或非极性键)。
(3)M2-、D+、G2-离子半径大小顺序是___ > > (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为__________ ,_____________ 。
②溶液c中的离子方程式为____________________ 。
(5)将0.5molD2M2投入100mL3mol/LECl3溶液中,转移电子的物质的量为________________ 。
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压 灯,发出的黄光透 雾力强、射程远 | 氢化物常温下呈液 态,M的双原子阴 离子有18个电子 | 原子核外M 层比L层少2 个电子 | +3价阳离子的 核外电子排布 与氖原子相同 |
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、4 |
(1)元素A在元素周期表中的位置为
(2)写出钙与M原子个数比为1:2的化合物的电子式
(3)M2-、D+、G2-离子半径大小顺序是
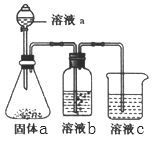
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为
②溶液c中的离子方程式为
(5)将0.5molD2M2投入100mL3mol/LECl3溶液中,转移电子的物质的量为
您最近一年使用:0次



