1 . ①、②、③、④是原子序数依次增大的四种短周期元素,①周期表中原子半径最小的元素,②的最外层电子数比次外层多1,③的第一电离能比左右相邻两元素的都要大,④是周期表中电负性最大的元素。元素①和③可形成一种三角锥形的分子A,元素②和④可形成一种平面三角形的分子B。
(1)元素②的基态原子的电子排布式为___________ 。
(2)元素③的价电子的轨道表示式为___________ 。
(3)已知元素①与②形成的化合物中元素①呈负价,将元素①、②、③、④按电负性由大到小排序:___________ (用元素符号表示)。
(4)分子A的电子式为___________ ,分子B的中心原子杂化方式为___________ ;A与B之间能否形成配位键?若能,用化学用语表示出两者之间的配位键;若不能,说明理由:___________ 。
(5)这四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:___________ 。
(1)元素②的基态原子的电子排布式为
(2)元素③的价电子的轨道表示式为
(3)已知元素①与②形成的化合物中元素①呈负价,将元素①、②、③、④按电负性由大到小排序:
(4)分子A的电子式为
(5)这四种元素可形成一种离子化合物,其阴、阳离子均为正四面体结构,阴、阳离子各含其中两种元素,写出一种符合要求的化学式:
您最近一年使用:0次
2 . 写出下列概念的含义:
(1)反应的热效应:_______________________________ 。
(2)泡利不相容原理:______________________________ 。
(1)反应的热效应:
(2)泡利不相容原理:
您最近一年使用:0次
3 . 为什么第一个电子层最多容纳2个电子?第二层最多只能容纳8个电子?第三、四、五电子层最多能容纳的电子数分别是多少?_________
您最近一年使用:0次
4 . 最外层电子数目的变化
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从_____ 逐渐增加到_____ 的周期性变化。
除第1周期外,每隔一定数目的元素,元素原子的最外层电子数重复出现从
您最近一年使用:0次
5 . 若某元素原子核外有4个电子层,最外层有2个电子。请写出满足上述条件的该元素的元素符号_____ 。
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)无机化合物甲、乙分别由三种元素组成。组成甲、乙化合物的元素原子的特征排布都可表示如下:asa、bsbbpb、csccp2c甲是一种溶解度较小的盐类化合物。由此可知甲、乙的化学式分别是___________ 、___________ 。
(2)根据周期表对角线规则,金属铍与铝的单质及其化合物性质相似,又已知氯化铝的熔、沸点较低,易升化。氢氧化铍与氢氧化镁可用___________ 鉴别,其离子方程式是___________ 。
(3)已知砷(As)元素原子的最外层电子排布是 4s24p3,砷酸钠在酸性条件下能把碘化钾氧化为单质碘,同时生成亚砷酸钠(Na3AsO3)和水,该反应的离子方程式为___________ 。
(1)无机化合物甲、乙分别由三种元素组成。组成甲、乙化合物的元素原子的特征排布都可表示如下:asa、bsbbpb、csccp2c甲是一种溶解度较小的盐类化合物。由此可知甲、乙的化学式分别是
(2)根据周期表对角线规则,金属铍与铝的单质及其化合物性质相似,又已知氯化铝的熔、沸点较低,易升化。氢氧化铍与氢氧化镁可用
(3)已知砷(As)元素原子的最外层电子排布是 4s24p3,砷酸钠在酸性条件下能把碘化钾氧化为单质碘,同时生成亚砷酸钠(Na3AsO3)和水,该反应的离子方程式为
您最近一年使用:0次
7 . 回答下列问题:
(1)已知短周期元素A、B,A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为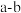 ,L层电子数为
,L层电子数为 ,则A为
,则A为___________ (填元素符号,下同),B为___________ 。
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子多5,则X、Y分别为___________ 、___________ 。
(1)已知短周期元素A、B,A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为
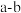 ,L层电子数为
,L层电子数为 ,则A为
,则A为(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子多5,则X、Y分别为
您最近一年使用:0次
解题方法
8 . 按要求填空:
(1)基态Si原子中,电子占据的能量最高的电子层符号为_______ ,该电子层具有的原子轨道数为_______ ,具有的电子数为_______
(2)基态N原子中,核外电子占据_______ 个电子层,_______ 个原子轨道,共有_______ 种运动状态;电子占据的能量最高的原子轨道的形状为_______ 。
(1)基态Si原子中,电子占据的能量最高的电子层符号为
(2)基态N原子中,核外电子占据
您最近一年使用:0次
2022-08-22更新
|
240次组卷
|
2卷引用:专题2 原子结构与元素性质 第一单元 原子核外电子的运动 第1课时 人类对原子结构的认识 原子核外电子的运动特征
名校
9 . 按要求完成下列问题。
(1)物质A的结构简式为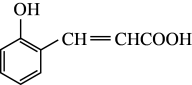 ,写出A中的含氧官能团名称
,写出A中的含氧官能团名称_______ 。
(2)有机化合物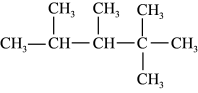 的名称是
的名称是_____ ,其在核磁共振氢谱上有_____ 组峰。
(3)实验室制取乙炔的反应方程式为_______ 。
(4)利用甲苯合成TNT的反应方程式为_______ 。
(5)区分晶体与非晶体最可靠的方法是_______ ,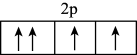 违反了
违反了_______ 。
(1)物质A的结构简式为
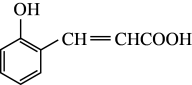 ,写出A中的含氧官能团名称
,写出A中的含氧官能团名称(2)有机化合物
 的名称是
的名称是(3)实验室制取乙炔的反应方程式为
(4)利用甲苯合成TNT的反应方程式为
(5)区分晶体与非晶体最可靠的方法是
 违反了
违反了
您最近一年使用:0次
名校
10 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________ ,占据最高能级电子的电子云轮廓图为___________ 形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
②比较Mg、Ca第一电离能的大小:___________ 。O的第一电离能小于N,原因是___________ 。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
结合数据说明Mg的常见化合价为+2价的原因:___________ 。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________ ,铁在元素周期表中的位置___________ 。
②比较Li+与H-的半径大小关系:r(Li+)___________ r(H-)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca第一电离能的大小:
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
| 元素 | Na | Mg | Al |
| 电离能(kJ/mol) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为
②比较Li+与H-的半径大小关系:r(Li+)
您最近一年使用:0次
2022-03-15更新
|
800次组卷
|
4卷引用:北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题



