名校
1 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。铅元素位于元素周期表第六周期IVA,IVA中原子序数最小的元素的原子有___ 种能量不同的电子,其次外层的电子云有___ 种不同的伸展方向。与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是___ (填化学式),气态氢化物沸点最低的是___ (填化学式)。
您最近一年使用:0次
名校
2 . 回答下列问题。
Ⅰ.用“>”或“<”填空:
(1)键长:N-N___________ N=N
(2)键能:2E(C-C)___________ E(C=C)
(3)键角:CO2___________ SO2;
(4)键的极性:C-H___________ N-H。
Ⅱ.指出下列原子的杂化轨道类型及分子的空间构型。
(1)NO 中的N
中的N___________ 杂化,空间构型___________ ;
(2)BCl3中的B___________ 杂化,空间构型___________ ;
Ⅲ.已知有1H216O 3H218O S17O2 2H2S S16O2,其中包含___________ 种元素,___ 种核素,___________ 种相对分子质量。
Ⅳ.元素X的原子最外层电子排布式为nsnnpn+1.试解答下列各题:
原子中能量最高的是___________ 电子,原子轨道呈现___________ 形,它的氢化物的电子式是___________
Ⅰ.用“>”或“<”填空:
(1)键长:N-N
(2)键能:2E(C-C)
(3)键角:CO2
(4)键的极性:C-H
Ⅱ.指出下列原子的杂化轨道类型及分子的空间构型。
(1)NO
 中的N
中的N(2)BCl3中的B
Ⅲ.已知有1H216O 3H218O S17O2 2H2S S16O2,其中包含
Ⅳ.元素X的原子最外层电子排布式为nsnnpn+1.试解答下列各题:
原子中能量最高的是
您最近一年使用:0次
解题方法
3 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;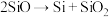 ;
;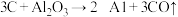
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;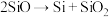 ;
;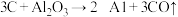
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
416次组卷
|
3卷引用:上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)
20-21高二·全国·单元测试
4 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_______ 。
(2)黄血盐中C、N、O的第一电离能由大到小的排序为_______ ,电负性由大到小的排序为_______ 。
(1)写出基态Fe3+的核外电子排布式
(2)黄血盐中C、N、O的第一电离能由大到小的排序为
您最近一年使用:0次
名校
5 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____________ .
A.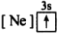 B.
B.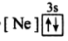 C.
C.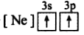 D.
D.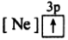
(2) 成为阳离子时首先失去
成为阳离子时首先失去____________ 轨道电子, 的价层电子排布式为
的价层电子排布式为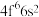 ,
,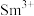 价层电子排布式为
价层电子排布式为____________ .比较离子半径:
____________ (填“大于”“小于”或“等于”) .
.
(3)在周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子核外 层电子的自旋
层电子的自旋___________ (填“相同”或“相反”). 中,电负性最高的元素是
中,电负性最高的元素是___________ .
(4) 基态核外电子排布式为
基态核外电子排布式为___________ .
A.
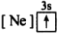 B.
B.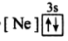 C.
C. D.
D.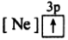
(2)
 成为阳离子时首先失去
成为阳离子时首先失去 的价层电子排布式为
的价层电子排布式为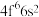 ,
,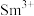 价层电子排布式为
价层电子排布式为
 .
.(3)在周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 层电子的自旋
层电子的自旋 中,电负性最高的元素是
中,电负性最高的元素是(4)
 基态核外电子排布式为
基态核外电子排布式为
您最近一年使用:0次
2021-02-01更新
|
1080次组卷
|
4卷引用:鲁科版2019选择性必修2第1章 原子结构与元素性质 第1章学科素养提升
名校
解题方法
6 . 按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___ ,第一电离能最小的元素的电子排布图为___ 。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
① ②
② ③
③ ④
④ ⑤
⑤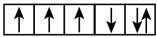 ⑥
⑥
违反泡利不相容原理的有__ ,违反洪特规则的有___ 。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
违反泡利不相容原理的有
(3)用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
| CH2O | |||
| NH4+ | |||
| CS2 |
您最近一年使用:0次
19-20高二·浙江·阶段练习
解题方法
7 . (1)地壳由90多种化学元素组成,其含量最高的几种元素依次为①氧②硅③铝④铁,写出氧原子的结构示意图_______________ ;写出一种与氖具有相同核外电子 排布的离子___________ 。
(2)下列物质中① ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是________ 属于非电解质的是________ ;(以上填写物质编号);写出②的电离方程式__________________ 。
(2)下列物质中①
 ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是
您最近一年使用:0次
名校
8 . I、用符号“>”、“<”或“=”连接下列各项关系。
(1)第一电离能:Na__________ Mg,Mg__________ Ca。
(2)电负性:O__________ F,F__________ Cl。
(3)能量高低:ns__________ (n+1)s,ns__________ np。
(4)主族序数__________ 该原子的价电子数__________ 元素最高正化合价。
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________ 晶体,它的电子式为__________ 。
(2)A溶于水后溶液呈____ 性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示)_______ 。
(1)第一电离能:Na
(2)电负性:O
(3)能量高低:ns
(4)主族序数
II、固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于
(2)A溶于水后溶液呈
您最近一年使用:0次
名校
9 . 按要求填写:
(1)二氧化碳的电子式:______________ ;小苏打的化学式:________________ ;质子数为6、中子数为6的原子结构示意图____________________ 。
(2)氯气与氢氧化钠溶液反应的化学方程式______________________________ 。
(1)二氧化碳的电子式:
(2)氯气与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分。
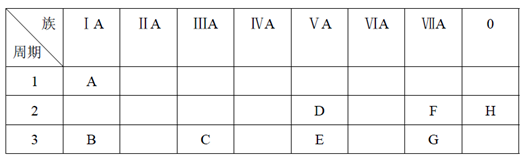
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______ ,还原性最强的单质是______ ,化学性质最不活泼的单质是______ 。(填相应的化学式)
(2)最稳定的氢化物是______ 。(填相应的化学式)
(3)一个E原子的核外电子总共有______ 种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______ 。(填相应的化学式)

根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是
(2)最稳定的氢化物是
(3)一个E原子的核外电子总共有
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是
您最近一年使用:0次
2018-05-28更新
|
555次组卷
|
2卷引用:【全国百强校】四川省南充高级中学2017-2018学年高二下学期期中化学试题



