1 . 氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH3OH和H2O在某Cu/Zn-Al催化剂存在下生产H2, H2与Mg在一定条件下制得储氢物质X。
回答问题: .
(1) Al在周期表中的位置______________ 。基态Zn的价层电子排布式___________ 。
(2)水分了中氧原子的杂化轨道类型_______________ 。
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有_________ 种键能数据。CH3OH可以与水以任意比例互溶的原因是___________________ 。
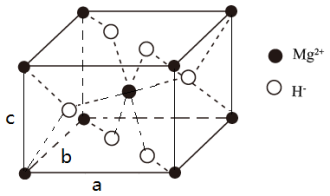
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为______________ , X的储氢质量分数是______________ ,c= ___________ pm (列出计算式即可)。
回答问题: .
(1) Al在周期表中的位置
(2)水分了中氧原子的杂化轨道类型
(3)键能是衡量共价键稳定性的参数之一。 CH3OH键参数中有
(4) X的晶胞结构如图所示(晶胞参数:α =β =γ=90º,a=b=450.25 pm),密度为1.4g cm-3, H-的配位数为

您最近一年使用:0次
2020-10-12更新
|
4052次组卷
|
5卷引用:2020年海南省高考化学试卷(新高考)
2020年海南省高考化学试卷(新高考)(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)2020年海南卷化学高考真题变式题15-19北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
19-20高二·浙江·阶段练习
解题方法
2 . (1)地壳由90多种化学元素组成,其含量最高的几种元素依次为①氧②硅③铝④铁,写出氧原子的结构示意图_______________ ;写出一种与氖具有相同核外电子 排布的离子___________ 。
(2)下列物质中① ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是________ 属于非电解质的是________ ;(以上填写物质编号);写出②的电离方程式__________________ 。
(2)下列物质中①
 ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是
您最近一年使用:0次
解题方法
3 . 我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是______________________________ 。
(2)铝元素原子核外有_____ 种不同运动状态的电子,最外层电子排布式为___________ 。
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式_____________________________ (写一个即可)。
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱_____________
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:______________________________________ ;写出其现象中的一个离子方程式_________________ 。

| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是
(2)铝元素原子核外有
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:
您最近一年使用:0次
4 . 以下元素均为短周期元素:
(1)B在周期表中的位置______ ,C离子的结构示意图_______ 。
(2)D的最低价含氧酸的电子式______ 。
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式____ 。(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:______ 。
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为___________ 。
元素代号 | 相关信息 |
M | 非金属元素,其气态氢化物的水溶液呈碱性 |
A | A的单质与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是内层电子数的三倍 |
C | 在第三周期中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)B在周期表中的位置
(2)D的最低价含氧酸的电子式
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质。该反应的化学方程式:
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为
您最近一年使用:0次
5 . 有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置__________ ;E元素价电子排布式为__________ 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是______ (写分子式)。
(3)B与D形成的非极性分子的电子式为________ 。
(4)B、C、D三种元素的第一电离能由大到小的顺序是_____ (用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________ 。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(l)=BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(l)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示):_______ 。
(1)E元素在周期表中的位置
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是
(3)B与D形成的非极性分子的电子式为
(4)B、C、D三种元素的第一电离能由大到小的顺序是
(5)C的单质分子中σ键和π键的个数比为
(6)已知在25℃、101kPa下:ABC(aq)+A2D(l)=BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(l)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示):
您最近一年使用:0次



