名校
解题方法
1 . 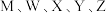 是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
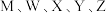 是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
A.原子半径: |
| B.X的氧化物一定属于酸性氧化物 |
| C.在Q的结构中,所有原子最外层均满足8电子稳定结构 |
| D.Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键 |
您最近一年使用:0次
2023-12-05更新
|
1973次组卷
|
11卷引用:四川省成都市石室中学2023-2024学年高三上学期期末考试理综试题-高中化学
四川省成都市石室中学2023-2024学年高三上学期期末考试理综试题-高中化学吉林省长春市东北师大附中2023-2024学年高三上学期第三次摸底考试化学科试卷宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期第四次月考理综试题湖南省永州市第一中学2023-2024学年高二上学期12月月考化学试题福建省泉州市培元中学2023-2024学年高三上学期12月月考化学试题(已下线)选择题11-16(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题陕西省西安中学2023-2024学年高三下学期模拟预测(五)理综试题-高中化学
解题方法
2 . 甲酸 被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
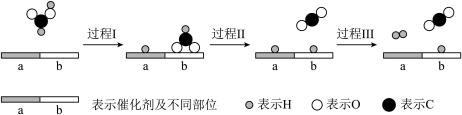
(1) 中官能团的名称是
中官能团的名称是_______ 。
(2)常压下甲酸的沸点是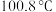 。甲酸沸腾的过程中,外界提供的能量的作用是
。甲酸沸腾的过程中,外界提供的能量的作用是_______ 。
(3)过程Ⅰ中断裂的化学键是_______ ,过程Ⅲ中形成的化学键是_______ 。
(4) 分解制氢的总反应方程式是
分解制氢的总反应方程式是_______ ,两种产物的电子式分别是_______ 、_______ 。
(5) 分解制氢是一个可逆反应。在密闭容器中,通入
分解制氢是一个可逆反应。在密闭容器中,通入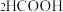 蒸汽,一段时间后,核素
蒸汽,一段时间后,核素 存在于以下分子中:
存在于以下分子中:_______ 。
 被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
(1)
 中官能团的名称是
中官能团的名称是(2)常压下甲酸的沸点是
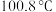 。甲酸沸腾的过程中,外界提供的能量的作用是
。甲酸沸腾的过程中,外界提供的能量的作用是(3)过程Ⅰ中断裂的化学键是
(4)
 分解制氢的总反应方程式是
分解制氢的总反应方程式是(5)
 分解制氢是一个可逆反应。在密闭容器中,通入
分解制氢是一个可逆反应。在密闭容器中,通入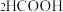 蒸汽,一段时间后,核素
蒸汽,一段时间后,核素 存在于以下分子中:
存在于以下分子中:
您最近一年使用:0次
名校
3 . X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g· L-1;W的质子数是X、Y、Z、M四种元素质子数之和的 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.原子半径:W>X> Y> Z>M |
| B.XZ2、X2M2、W2Z2均为共价化合物 |
| C.CaM2和CaZ2两种化合物中,阳离子与阴离子个数比均为1:2 |
| D.由X、Y、Z、M四种元素共同形成的化合物中一定有共价键,可能有离子键 |
您最近一年使用:0次
2022-03-18更新
|
1308次组卷
|
5卷引用:河南省信阳高中2021-2022学年高一上学期期末考试化学试题
4 . 已知A、B、C、D、E、F为周期表中前四周期的六种元素。A是周期表中原子半径最小的元素;B的基态原子有2个不同的能级且各能级中电子数相等;C核外有五种运动状态不同的电子;D是电负性最大的元素; 离子与
离子与 离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为
离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为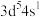 。请回答下列问题:
。请回答下列问题:
(1)B、C、D三种元素的第一电离能由大到小的顺序是___________ (填元素符号)。
(2)A、C、E可形成一种化合物M,M是有机合成中常用的还原剂,其阴离子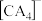 的空间构型是
的空间构型是___________ ,M中存在的作用力有___________ 填标号)。
a.离子键 b.氢键 c. 键 d.
键 d. 键
键
(3)B与Cl形成的化合物中,化学键具有明显的共价性,其蒸汽状态下以双聚分子存在。写出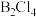 的结构式(用元素符号表示)
的结构式(用元素符号表示)___________ ,其中B的杂化类型为___________ 。
(4)第三周期元素与D形成的化合物的熔点如下表:
解释表中化合物熔点变化的原因:___________ 。
(5)现有含F(Ⅲ)的两种氯化物的有颜色晶体, 的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为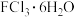 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液﹔
b.分别往待测溶液中滴入 溶液,均产生白色沉淀﹔
溶液,均产生白色沉淀﹔
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
试推断紫色晶体的化学式为___________ 。
(6)氢气是理想的清洁能源,镍(Ni)元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示 ﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为
﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为___________ ,已知该晶体的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则该晶胞的边长是
,则该晶胞的边长是___________ nm。
 离子与
离子与 离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为
离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为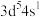 。请回答下列问题:
。请回答下列问题:(1)B、C、D三种元素的第一电离能由大到小的顺序是
(2)A、C、E可形成一种化合物M,M是有机合成中常用的还原剂,其阴离子
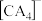 的空间构型是
的空间构型是a.离子键 b.氢键 c.
 键 d.
键 d. 键
键(3)B与Cl形成的化合物中,化学键具有明显的共价性,其蒸汽状态下以双聚分子存在。写出
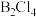 的结构式(用元素符号表示)
的结构式(用元素符号表示)(4)第三周期元素与D形成的化合物的熔点如下表:
| 化合物 | NaD | 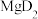 | 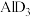 | 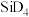 | 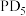 | 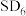 |
| 熔点/℃ | 993 | 1261 | 1291 | 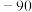 | 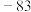 | 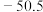 |
(5)现有含F(Ⅲ)的两种氯化物的有颜色晶体,
 的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为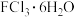 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液﹔
b.分别往待测溶液中滴入
 溶液,均产生白色沉淀﹔
溶液,均产生白色沉淀﹔c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与
 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。试推断紫色晶体的化学式为
(6)氢气是理想的清洁能源,镍(Ni)元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示
 ﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为
﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则该晶胞的边长是
,则该晶胞的边长是
您最近一年使用:0次
名校
解题方法
5 . 固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,下列有关说法中不正确的是
| A.1molNH5中含有5NA个N-H键 | B.NH5是离子化合物 |
C.NH5的电子式为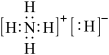 | D.NH5与水反应的化学方程式为NH5+H2O=NH3•H2O+H2↑ |
您最近一年使用:0次
2020-08-20更新
|
1744次组卷
|
6卷引用:辽宁省本溪满族自治县高级中学2019-2020学年高一下学期期末考试化学试题
解题方法
6 . 短周期主族元素 X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。

下列说法正确的是

下列说法正确的是
| A.化合物 RX 中含有共价键 |
| B.Y、Z、M 的氧化物均能溶于水 |
| C.化合物R2M 是弱电解质,其水溶液显碱性 |
| D.试管壁上残留的M 单质可以用热的NaOH溶液除去 |
您最近一年使用:0次
2013·辽宁·模拟预测
名校
解题方法
7 . 固体A的化学式为NH5,其所有原子的最外电子层结构都符合相应稀有气体元素原子的最外电子层结构,则下列有关说法不正确的是( )
| A.1 mol NH5中含有5NA个N—H键(设NA表示阿伏加 德罗常数的值) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为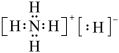 |
| D.NH5与水反应的离子方程式为NH4++H-+H2O=NH3·H2O+H2↑ |
您最近一年使用:0次
2020-03-26更新
|
1073次组卷
|
22卷引用:2014-2015学年黑龙江省龙东南四校高一下学期期末联考化学试卷
2014-2015学年黑龙江省龙东南四校高一下学期期末联考化学试卷(已下线)2013届辽宁省东北育才双语学校高三第五次模拟化学试卷(已下线)2014高考化学名师知识点精编 专题6原子结构化学键练习卷2015-2016学年吉林省前郭县五中高一下学期第一次月考化学试卷2015-2016学年四川省成都市新都一中高一下4月月考化学试卷2017届重庆市巴蜀中学高三上学期开学考试化学试卷2017届河北省定州中学高三上第三次月考化学试卷2016-2017学年辽宁省实验中学北校高一3月月考化学试卷2016-2017学年重庆市南川区三校高一下学期期中考试化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题【全国百强校】安徽省合肥市第一六八中学2018-2019学年高一下学期期中考试化学试题天津市七校(静海一中、宝坻一中、杨村一中等)2020届高三上学期期中联考化学试题山西省运城市永济涑北中学2019-2020学年高一下学期3月月考化学试题吉林省长春外国语学校2020-2021学年高二上学期期初考试化学试题(已下线)4.3.1 离子键(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.3.1 离子键-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)天津市第八中学2021届高三上学期第三次统练化学试题(已下线)练习8 化学键2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题福建省龙岩市武平县第一中学2020-2021学年高二下学期化学月考试题
名校
8 . 下列说法正确的是
| A.共价化合物中可能含有离子键 |
| B.离子化合物中只含有离子键 |
| C.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电 |
| D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子 |
您最近一年使用:0次
2017-10-11更新
|
1326次组卷
|
4卷引用:广西柳州市城中区第二中学2016-2017学年高一下学期期末考试化学试题
广西柳州市城中区第二中学2016-2017学年高一下学期期末考试化学试题河南省林州市2020-2021学年高一下学期期末考试化学试题(已下线)2019年3月10日 《每日一题》人教必修2-每周一测甘肃省兰州市第一中学2019-2020学年高一4月月考化学试题
10-11高一下·河北石家庄·期末
名校
9 . 下列物质中,含有非极性共价键的离子化合物的是
| A.NH4NO3 | B.Cl2 | C.H2O2 | D.Na2O2 |
您最近一年使用:0次
2017-07-13更新
|
372次组卷
|
7卷引用:2010-2011学年河北省正定中学高一下学期期末考试化学试卷
(已下线)2010-2011学年河北省正定中学高一下学期期末考试化学试卷广西钦州市钦州港经济技术开发区2016-2017学年高一下学期期末考试化学试题湖南省衡阳市第八中学2016-2017学年高一理科实验班下学期结业(期末)理综化学试题(已下线)2021年1月浙江高考化学试题变式题1-10上海市七宝中学2022-2023学年高三上学期9月月考化学试题上海市育才中学2022-2023学年高三上学期期中考试化学试题(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题1-5)
名校
解题方法
10 . 现有部分元素的性质与原子(或分子)结构如表所示:
⑴元素Y与元素Z相比,金属性较强的是 ________ (用元素符号表示)。下列能证明这一事实的是 _________ (填字母)。
a、Y单质的熔点比Z单质低
b、Y的化合价比Z低
c、Y单质与水反应比Z单质剧烈
d、Y的最高价氧化物对应的水化物的碱性比Z的强
⑵T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,用电子式表示该化合物的形成过程:_________________________________________ 。
⑶元素T和氢元素以原子个数比为1∶1形成化合物Q,元素X与氢元素以原子个数比为1∶2形成常用于火箭燃料的化合物W, Q与W发生反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:_____________________________ 。
⑷Z单质的晶胞结构如图乙所示,原子之间相对位置关系的平面图如图丙所示。
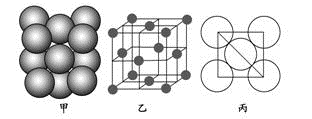
若已知Z原子半径为d,据上图计算,Z原子采取的面心立方堆积的空间利用率为_____ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
a、Y单质的熔点比Z单质低
b、Y的化合价比Z低
c、Y单质与水反应比Z单质剧烈
d、Y的最高价氧化物对应的水化物的碱性比Z的强
⑵T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,用电子式表示该化合物的形成过程:
⑶元素T和氢元素以原子个数比为1∶1形成化合物Q,元素X与氢元素以原子个数比为1∶2形成常用于火箭燃料的化合物W, Q与W发生反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:
⑷Z单质的晶胞结构如图乙所示,原子之间相对位置关系的平面图如图丙所示。

若已知Z原子半径为d,据上图计算,Z原子采取的面心立方堆积的空间利用率为
您最近一年使用:0次



