1 .  是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示
 是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示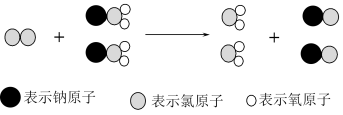
| A.该反应是复分解反应 |
B.该反应的化学方程式为  |
| C.反应过程中存在共价键、离子键的断裂与形成 |
D.生成 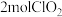 时转移的电子数为 时转移的电子数为 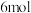 |
您最近一年使用:0次
解题方法
2 . 下表列出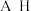 八种元素在周期表中的位置:
八种元素在周期表中的位置:
回答下列问题:
(1) 、
、 、
、 三种元素中,原子半径最大的是
三种元素中,原子半径最大的是___________ (填元素符号,下同)。
(2)写出 与
与 两元素最高价氧化物对应水化物反应的离子方程式:
两元素最高价氧化物对应水化物反应的离子方程式:___________ 。
(3)这八种元素中非金属性最强的元素是___________ 。
(4)写出 、
、 两元素形成的原子个数比为
两元素形成的原子个数比为 的物质的电子式:
的物质的电子式:___________ 。
(5) 的氢化物属于
的氢化物属于___________ (填“离子化合物”或“共价化合物”)。
该氢化物与水反应的化学方程式为___________ 。
(6) 和
和 两种元素形成的简单氢化物的稳定性
两种元素形成的简单氢化物的稳定性
___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
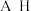 八种元素在周期表中的位置:
八种元素在周期表中的位置:| 周期 | 主族 | ||||||
Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 |  |  |  | ||||
| 3 |  |  |  |  | |||
| 4 |  | ||||||
(1)
 、
、 、
、 三种元素中,原子半径最大的是
三种元素中,原子半径最大的是(2)写出
 与
与 两元素最高价氧化物对应水化物反应的离子方程式:
两元素最高价氧化物对应水化物反应的离子方程式:(3)这八种元素中非金属性最强的元素是
(4)写出
 、
、 两元素形成的原子个数比为
两元素形成的原子个数比为 的物质的电子式:
的物质的电子式:(5)
 的氢化物属于
的氢化物属于该氢化物与水反应的化学方程式为
(6)
 和
和 两种元素形成的简单氢化物的稳定性
两种元素形成的简单氢化物的稳定性
 (填“大于”或“小于”)。
(填“大于”或“小于”)。
您最近一年使用:0次
3 . 下列物质中,含有极性共价键的是
A. | B. | C. | D. |
您最近一年使用:0次
4 . 下列说法正确的有
①离子键的本质是静电作用
②任何物质中都存在化学键
③离子键就是阴、阳离子之间的静电吸引力
④活泼金属与活泼非金属化合时能形成离子键
⑤任何共价键中,成键原子成键后均满足 稳定结构
稳定结构
⑥验证化合物是否为离子化合物的实验方法是可以看其熔融状态下能否导电
⑦两种非金属元素形成的化合物不可能含有离子键
⑧化学键断裂,一定发生化学变化
①离子键的本质是静电作用
②任何物质中都存在化学键
③离子键就是阴、阳离子之间的静电吸引力
④活泼金属与活泼非金属化合时能形成离子键
⑤任何共价键中,成键原子成键后均满足
 稳定结构
稳定结构 ⑥验证化合物是否为离子化合物的实验方法是可以看其熔融状态下能否导电
⑦两种非金属元素形成的化合物不可能含有离子键
⑧化学键断裂,一定发生化学变化
| A.1个 | B.2个 | C.3个 | D.4个 |
您最近一年使用:0次
名校
5 . 下列说法不正确的是
| A.依据周期律推测,卤素单质砹(At)为黑色固体,AgAt难溶于水也难溶于稀硝酸 |
| B.随着核电荷数的递增,卤素单质的沸点依次升高,原因是分子间作用力逐渐增大 |
| C.NH4Cl是共价化合物,Na2S是离子化合物 |
| D.氧化钙溶于水的过程中,既有离子键的断裂,又有共价键的断裂 |
您最近一年使用:0次
名校
解题方法
6 . 磷是一种生命元素,人类在金星大气中探测到PH3.实验室制备PH3的方法之一为PH4I+NaOH=NaI+PH3↑+H2O。下列说法错误的是
| A.磷的最高正价为+5 | B.该反应属于氧化还原反应 |
| C.NaOH为离子化合物 | D.稳定性H2S>PH3 |
您最近一年使用:0次
7 . 根据化学键,元素周期表和元素周期律知识判断,下列叙述不正确的是


A. 中只含有离子键 中只含有离子键 |
B.气态氢化物的稳定性: |
| C.金属元素和非金属元素分界线附近的元素多用于制造半导体材料 |
D.如图所示实验(左侧锥形瓶内有二氧化碳气体冒出,右侧试管中有硅酸产生)可证明元素的非金属性: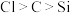 |
您最近一年使用:0次
8 . 利用反应CCl4+4Na 4NaCl+C(金刚石)可实现人工合成金刚石。下列说法正确的是
4NaCl+C(金刚石)可实现人工合成金刚石。下列说法正确的是
 4NaCl+C(金刚石)可实现人工合成金刚石。下列说法正确的是
4NaCl+C(金刚石)可实现人工合成金刚石。下列说法正确的是| A.反应过程中有离子键的断裂与形成 |
| B.熔点:C(金刚石)>Na>NaCl>CCl4 |
| C.NaCl晶体中,每个Cl–的周围距离其最近的Cl–有6个 |
D.金刚石晶胞中,若键长为apm,则晶胞参数为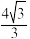 apm apm |
您最近一年使用:0次
9 .  溶于水,溶解过程如图所示。下列说法
溶于水,溶解过程如图所示。下列说法不正确 的是

 溶于水,溶解过程如图所示。下列说法
溶于水,溶解过程如图所示。下列说法
A.a离子为 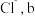 离子为 离子为  |
B. 在水分子的作用下, 在水分子的作用下, 和 和  之间的相互作用被破坏 之间的相互作用被破坏 |
C.通电后, 发生电离 发生电离 |
D. 溶液导电的原因是溶液中有自由移动的离子 溶液导电的原因是溶液中有自由移动的离子 |
您最近一年使用:0次
名校
10 . 电负性用来描述不同元素的原子对键合电子吸引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键):
下列说法不正确的是
| 元素 | Li | Be | B | C | N | F | Na | Mg | Al | Si | Cl | Ca |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 4.0 | 0.9 | a | 1.5 | 1.8 | 3.0 | 1.0 |
| A.根据电负性变化规律,确定a的最小范围为1.0<a<1.5 |
| B.NF3中N-F键的极性比NCl3中N-Cl键的极性强 |
| C.AlCl3是一种可溶性盐,属于离子化合物 |
| D.可以通过测定化合物在熔融状态下是否导电鉴别Li3N与SiC |
您最近一年使用:0次
2024-02-22更新
|
201次组卷
|
4卷引用:安徽省皖中联盟考试2023-2024学年高二上学期1月期末化学试题



