1 . 下表为元素周期表的一部分,请回答有关问题:
(1)元素⑨的原子结构示意图为___________ 。已知元素⑨的一种核素,其中子数为45,用原子符号表示该核素为___________ 。
(2)由元素②和④形成的三核直线形分子的结构式为___________ 。
(3)由元素④和⑤形成的淡黄色固体的电子式为___________ 。该物质所含的化学键有___________ 。
(4)元素⑥、⑦、⑧的离子半径由大到小的顺序是___________ (用离子符号表示);
(5)能比较元素非金属性强弱的实验事实是___________ (填字母序号)。
a.⑥的氢化物的酸性比⑦的氢化物的酸性弱
b.⑦的单质比⑥的单质更容易与 化合,且生成的氢化物更稳定
化合,且生成的氢化物更稳定
c.在⑥的氢化物 的水溶液中通少量⑦的单质
的水溶液中通少量⑦的单质 气体可置换出单质
气体可置换出单质
d.④的简单氢化物的沸点比⑥的氢化物沸点高
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ |
(2)由元素②和④形成的三核直线形分子的结构式为
(3)由元素④和⑤形成的淡黄色固体的电子式为
(4)元素⑥、⑦、⑧的离子半径由大到小的顺序是
(5)能比较元素非金属性强弱的实验事实是
a.⑥的氢化物的酸性比⑦的氢化物的酸性弱
b.⑦的单质比⑥的单质更容易与
 化合,且生成的氢化物更稳定
化合,且生成的氢化物更稳定c.在⑥的氢化物
 的水溶液中通少量⑦的单质
的水溶液中通少量⑦的单质 气体可置换出单质
气体可置换出单质
d.④的简单氢化物的沸点比⑥的氢化物沸点高
您最近一年使用:0次
名校
2 . W、X、Y、Z为原子序数依次增大的短周期主族元素。常温下,W和X的单质均为气体。Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。下列叙述错误的是
| A.原子半径:Y>Z>X>W |
| B.W与X形成化合物的水溶液可使酚酞变红 |
| C.Y的氧化物为碱性氧化物,不与强碱反应 |
| D.W和Z可形成含有共价键的化合物 |
您最近一年使用:0次
2022-01-23更新
|
479次组卷
|
2卷引用:广东省广州市海珠区2021-2022学年高一上学期期末考试化学试题
名校
解题方法
3 . 短周期主族元素X、Y、Z、W原子序数依次增大,四种元素组成的一种食品添加剂结构如图所示,Z的原子半径在短周期中最大,W基态原子的s能级电子总数是p能级电子总数的2/3。
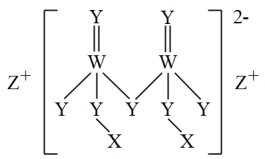
下列说法不正确的是

下列说法不正确的是
| A.Y、Z形成的简单离子半径: Y> Z |
| B.W、Y形成的简单氢化物沸点: Y > W |
| C.Z分别与X、Y形成的化合物中所含化学键类型一定完全相同 |
| D.WX3、X2Y中W原子和Y原子的杂化轨道类型相同 |
您最近一年使用:0次
2022-01-22更新
|
1137次组卷
|
8卷引用:广东省广州市荔湾区2021-2022学年高二下学期期末考试化学试题
名校
4 . 在下列物质中,含有共价键的化合物是
| A.Cl2 | B.Na2O | C.CaCl2 | D.CH4 |
您最近一年使用:0次
2022-01-20更新
|
85次组卷
|
2卷引用:广东省潮州市饶平县第二中学2021-2022学年高一下学期期初化学试题
名校
解题方法
5 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近一年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:广东省东莞市东华中学2021-2022学年高一下学期第一次月考化学试题(B卷)
名校
6 . “冰面为什么滑?”,这与冰层表面的结构有关,下列有关说法正确的是


| A.由于氢键的存在,水分子的稳定性好,高温下也很难分解 |
| B.第一层固态冰中,水分子间通过共价键形成空间网状结构 |
| C.第二层“准液体”中,水分子间形成共价键机会减少,形成氢键的机会增加 |
| D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑 |
您最近一年使用:0次
2021-12-03更新
|
458次组卷
|
6卷引用:广东省梅州市大埔县虎山中学2021-2022学年高二下学期第一次段考(4月)化学试题
广东省梅州市大埔县虎山中学2021-2022学年高二下学期第一次段考(4月)化学试题宁夏石嘴山市第三中学2021-2022学年高二上学期期中考试化学试题(已下线)2.3.2 分子间作用力 分子的手性-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(1-7)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第一次月考化学试题重庆市长寿中学校2022-2023学年高二下学期4月期中考试化学试题
9-10高一·广东·假期作业
名校
解题方法
7 . 烷烃分子中的碳原子与其他原子的结合方式是
| A.形成4对共用电子对 | B.通过非极性键 | C.通过两个共价键 | D.通过离子键和共价键 |
您最近一年使用:0次
2021-12-03更新
|
3305次组卷
|
37卷引用:09—10年广东省高一化学暑假化学作业
(已下线)09—10年广东省高一化学暑假化学作业(已下线)2011~2012学年广东省汕头市金山中学高二期中考试化学(文)试卷(已下线)2013-2014学年安徽省马鞍山二中高二上学期期中考试文科化学试卷(已下线)2013-2014安徽省马鞍山二中上学期期中高二文科化学试卷2014-2015学年湖北省宜昌市省示范高中高一期末化学试卷2014-2015学年陕西岐山县高一下学期期末质量检测化学试卷2015-2016学年辽宁省沈阳铁路实验中学高二上第二次月考化学试卷2015-2016学年黑龙江省哈尔滨三十二中高一下学期期末化学试卷海南省文昌中学2016-2017学年高一下学期期末考试(文)化学试题黑龙江省大庆中学2017-2018学年高二上学期期中考试化学试题河北省永清县第一中学2018-2019学年高一下学期第二次月考化学试题2020年春季人教版高中化学必修2第三章《有机化合物》测试卷江西省南昌市实验中学2019-2020学年高一5月摸底考试化学试题河南省开封市2019-2020学年高一下学期期末调研考试化学试题鲁科版(2019)高一必修第二册 第3章 简单有机化合物 第1节 认识有机化合物 教材帮(人教版2019)必修第二册 第七章 有机化合物 第一节 认识有机化合物(已下线)7.1.1 碳原子成键特点及烷烃的结构(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)吉林省长春市第二十中学2020-2021学年高二下学期第一次质量检测化学试题云南省砚山县第三高级中学2020-2021学年高一下学期期中考试化学试题河北省尚义一中2020-2021学年高二下学期期中考试化学试题渭南市尚德中学2020-2021学年高一下学期第二次质量检测化学试题天津市河北区2020-2021学年高一下学期期末考试化学试题湖南省岳阳临湘市2020-2021学年高一下学期期末考试化学试题辽宁省大连市第一中学2020-2021学年高一下学期期中(合格性)考试化学试题人教2019版必修第二册第七章第一节 认识有机化合物课后习题(已下线)第15讲 认识有机化合物(上)(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第09练 烃的结构与性质 有机高分子材料-2022年【暑假分层作业】高一化学(人教版2019必修第二册)黑龙江省鸡西市第四中学2021-2022学年高一下学期期中考试化学试题(已下线)【期末复习】必刷题(3)有机化合物-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)专题16 有机化合物的结构特点和研究方法-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第十二中学2022-2023学年高二上学期开学考试化学试题(已下线)7.1.1 碳原子的成键特点与烷烃的结构——同步学习必备知识第七章 有机化合物(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)四川省甘孜藏族自治州某重点中学2023-2024学年高一下学期4月期中考试化学试题天津市第十四中学2023-2024学年高一下学期期中考试化学试题(已下线)专题04 认识有机化合物 乙烯与有机高分子材料-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)江苏省连云港市七校2023-2024学年高二下学期期中联考化学试题
解题方法
8 . 研究化学键有助于人们理解物质的某些性质,下列物质中既含离子键又含共价键的是
| A.CaCl2 | B.SO2 | C.H2SO4 | D.KNO3 |
您最近一年使用:0次
解题方法
9 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)Ga原子的价电子排布式为___________ ;Ga、As和Se的第一电离能由小到大的顺序是___________ 。
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。
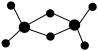
①该分子中Al原子采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有___________ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为___________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是___________ 。
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的___________ (填“正四面体形” 或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和As的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为___________ pm(列出表达式)。

(1)Ga原子的价电子排布式为
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
解题方法
10 . 下列物质中只含有极性共价键的是
A. | B. | C. | D. |
您最近一年使用:0次



