名校
解题方法
1 . 根据元素周期表和元素周期律判断,下列叙述不正确 的是
| A.氢元素与其他元素既可形成共价化合物也可形成离子化合物 |
| B.气态氢化物的稳定性:H2O > NH3 > SiH4 |
C.用中文“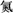 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
D.下图所示实验可证明元素的非金属性:Cl > C > Si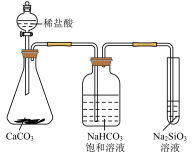 |
您最近一年使用:0次
2020-11-03更新
|
601次组卷
|
6卷引用:山东省济南市山东师范大学附属中学2019-2020学年高一下学期5月学业水平检测化学试题
山东省济南市山东师范大学附属中学2019-2020学年高一下学期5月学业水平检测化学试题(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第4章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)黑龙江省大庆铁人中学2020-2021学年高一下学期开学考试化学试题安徽省蚌埠田家炳中学2020-2021学年高一4月月考化学试题辽宁省朝阳市建平县实验中学2021-2022学年高一下学期第一次月考化学试题
名校
2 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:四川省江油中学2021届高三上学期开学考试理综化学试题
名校
解题方法
3 . 电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是___ (填离子符号),氢原子最外层电子的轨道表示式是___ 。
(2)NaCN中所含有的化学键类型是___ ,N2的电子式为___ 。
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目___ 。
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO___ mol。
(5)请用一个方程式证明氮元素的非金属性大于碳元素___ 。
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是
(2)NaCN中所含有的化学键类型是
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO
(5)请用一个方程式证明氮元素的非金属性大于碳元素
您最近一年使用:0次
解题方法
4 . 下列每一序号代表一种元素。元素①是常见的过渡元素,其氧化物为黑色且具有磁性。元素②~⑤的性质如表1和元素⑥~⑩在周期表中的位置如表2所示。请回答下列有关问题:
表1

(1)元素⑤的简单离子的结构示意图是_ ;所给元素中,其含氧化合物能用于漂白,该元素可能是_ (填元素符号)。
(2)元素④在元素周期表中的位置是___ ,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为_____ 。
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为______ 。
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为___ 。
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为__ (填化学式)。设计实验证明单质氧化性顺序为⑩>⑧____ 。
元素序号 | ② | ③ | ④ | ⑤ |
原子半径/pm | 130 | 118 | 75 | 73 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |

(1)元素⑤的简单离子的结构示意图是
(2)元素④在元素周期表中的位置是
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为
您最近一年使用:0次
2020-07-23更新
|
27次组卷
|
2卷引用:山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题
解题方法
5 . 下列说法正确的是
| A.氯化钠熔化时克服离子键,碘升华克服共价键 |
| B.HF分子很稳定是由于HF分子之间能形成氢键 |
| C.一氯甲烷只有一种空间结构,证明甲烷是正四面体的空间结构而不是平面结构 |
| D.分子式为C5H12O且能与钠反应的有机物的同分异构体有8种 |
您最近一年使用:0次
名校
解题方法
6 . (I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

(1)仪器A的名称是________ ,应盛放下列药品中的__________ 。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________ ,应盛放下列药品中的__________ 。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________ ,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________ 。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________ ,
②既存在离子键又存在极性键的是__________________ 。

(1)仪器A的名称是
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:
H2S:
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是
②既存在离子键又存在极性键的是
您最近一年使用:0次
7 . 下表列出了9种元素在元素周期表中的位置示意。
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________ ,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
| 周期 | ⅠA 1 | 0 18 | ||||||
| 1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ | |||||||
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
2020-01-26更新
|
189次组卷
|
2卷引用:山东省济宁市2019-2020学年高一上学期期末考试化学试题
8 . 七种短周期元素A、B、C、D、E、F、G的原子序数依次增大,A和E同族,D和F同族,C离子、D离子和E离子具有相同的电子层结构。A与除E以外的元素均能形成共价型化合物。A和C形成的化合物在水中呈碱性,C和D紧邻,B是形成化合物种类最多的元素。
回答下列问题:
(1)七种元素中,原子半径最大的是_____ (填元素符号);该元素在周期表中的位置_______
(2)由A、D、E三元素组成的化合物,该化合物含有的化学键类型为__________ 。
(3)A与B形成的10电子化合物,该化合物的空间构型为__________
(4)由A、C、D三种元素形成的化合物既含有离子键又含有共价键,该化合物的化学式为________
(5)用上述元素组成的物质写一个反应方程式,要求能够证明非金属性G>F___
(6)A与D,D与E形成的化合物都可以用来制取单质D,其中属于共价化合物来制取单质D的反应方程式为___________
回答下列问题:
(1)七种元素中,原子半径最大的是
(2)由A、D、E三元素组成的化合物,该化合物含有的化学键类型为
(3)A与B形成的10电子化合物,该化合物的空间构型为
(4)由A、C、D三种元素形成的化合物既含有离子键又含有共价键,该化合物的化学式为
(5)用上述元素组成的物质写一个反应方程式,要求能够证明非金属性G>F
(6)A与D,D与E形成的化合物都可以用来制取单质D,其中属于共价化合物来制取单质D的反应方程式为
您最近一年使用:0次
9 . 现有部分元素的性质与原子(或分子)结构如下表:
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____ 周期第_____ 族
(2)元素T与X相比,原子半径较大的是________ (用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________ 该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________ (用元素符号表示);
下列表述中能证明这一事实的是________ (填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(1)元素T在周期表中位于第
(2)元素T与X相比,原子半径较大的是
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为
(4)元素Y与元素Z相比,金属性较强的是
下列表述中能证明这一事实的是
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:
您最近一年使用:0次
名校
10 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3包括以下两个反应:
①11KClO3+6I2+3H2O == 6KH(IO3)2 +3Cl2↑+5KCl
②KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是( )
①11KClO3+6I2+3H2O == 6KH(IO3)2 +3Cl2↑+5KCl
②KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是( )
| A.化合物KH(IO3)2中含有共价键、离子键和氢键等化学键 |
| B.反应①中每转移4mol电子生成2.24LCl2 |
| C.向淀粉溶液中加入少量碘盐,溶液会变蓝 |
| D.可用焰色反应实验证明碘盐中含有钾元素 |
您最近一年使用:0次
2019-05-26更新
|
742次组卷
|
4卷引用:【全国百强校】湖北省黄冈中学2019届高三下学期5月第二次模拟考试理科综合化学试题



