名校
1 . 下列说法中正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
B.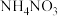 晶体中含共价键,是共价化合物 晶体中含共价键,是共价化合物 |
C.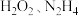 分子中只含有共价键 分子中只含有共价键 |
| D.某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键 |
您最近一年使用:0次
2022-05-23更新
|
238次组卷
|
9卷引用:2015-2016学年四川省资阳市高一下学期期末化学试卷
2015-2016学年四川省资阳市高一下学期期末化学试卷四川省自贡市田家炳中学2021届高三上学期开学考试化学试题四川省成都外国语学校2020-2021学年高一下学期第三次(6月)月考化学试题(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东师范大学附属中学2021-2022学年高一下学期期中考试(等级考)化学试题浙江省舟山市普陀中学2021-2022学年高一下学期6月月考化学试题(已下线)专题五 元素周期律 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)【2022】【高二上】【期中考】【高中化学】61(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构
名校
2 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:四川省江油中学2021届高三上学期开学考试理综化学试题
名校
3 . X、Y、Z、M、W、Q、R是7种短周期元素,其性质如下:
完成下列填空:
(1)上述元素中,X在周期表中的位置是__ ,由Y、Q形成的简单离子半径大小关系是Y___ Q(填“>”或“<”)。
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为___ ,是18e-分子的有__ 种。
(3)写出证明Z、M非金属性强弱的化学方程式为__ 。
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为___ 。(填选项)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | ||
| 主要化合价 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | ||
| 其它 | 焰色为黄色 | 形成气体单质密度最小 |
(1)上述元素中,X在周期表中的位置是
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为
(3)写出证明Z、M非金属性强弱的化学方程式为
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
您最近一年使用:0次
2020-11-14更新
|
149次组卷
|
2卷引用:湖南省衡阳市第一中学2021届高三上学期期中考试化学试题
名校
解题方法
4 . 根据元素周期表和元素周期律判断,下列叙述不正确 的是
| A.氢元素与其他元素既可形成共价化合物也可形成离子化合物 |
| B.气态氢化物的稳定性:H2O > NH3 > SiH4 |
C.用中文“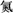 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
D.下图所示实验可证明元素的非金属性:Cl > C > Si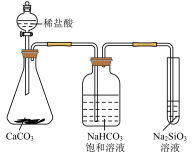 |
您最近一年使用:0次
2020-11-03更新
|
600次组卷
|
6卷引用:山东省济南市山东师范大学附属中学2019-2020学年高一下学期5月学业水平检测化学试题
山东省济南市山东师范大学附属中学2019-2020学年高一下学期5月学业水平检测化学试题(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第4章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)黑龙江省大庆铁人中学2020-2021学年高一下学期开学考试化学试题安徽省蚌埠田家炳中学2020-2021学年高一4月月考化学试题辽宁省朝阳市建平县实验中学2021-2022学年高一下学期第一次月考化学试题
5 . 下表为元素周期表的短周期区域一部分,回答下列问题:
(1)⑤的简单离子结构示意图为 ,此元素在周期表中的位置为
,此元素在周期表中的位置为________ ,同主族元素中,非金属性强于此元素的有___________ (填元素符号)。
(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程__________ 。
(3)②、③、④元素的简单离子半径由大到小的顺序为_________ (填离子符号)。
(4)由③、④组成的化合物中可能含有化学键的类型为_______________ 。
(5)②与③的简单氢化物稳定性更强的是_______ (填化学式)。
(6)设计实验证明②的非金属性强于①:____________________ 。
| ① | ② | ③ | ||||
| ④ | ⑤ |
 ,此元素在周期表中的位置为
,此元素在周期表中的位置为(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程
(3)②、③、④元素的简单离子半径由大到小的顺序为
(4)由③、④组成的化合物中可能含有化学键的类型为
(5)②与③的简单氢化物稳定性更强的是
(6)设计实验证明②的非金属性强于①:
您最近一年使用:0次
名校
解题方法
6 . 电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是___ (填离子符号),氢原子最外层电子的轨道表示式是___ 。
(2)NaCN中所含有的化学键类型是___ ,N2的电子式为___ 。
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目___ 。
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO___ mol。
(5)请用一个方程式证明氮元素的非金属性大于碳元素___ 。
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:NaOCN+NaClO→Na2CO3+CO2↑+NaCl+N2↑(未配平)
完成下列填空:
(1)上述反应涉及的元素Na、N、O中,简单离子半径最小的是
(2)NaCN中所含有的化学键类型是
(3)已知NaOCN中N元素为-3价,配平第二段过程的化学方程式并标出电子转移的方向和数目
(4)综合两段反应,处理含有0.01molNaCN的废水,至少需NacClO
(5)请用一个方程式证明氮元素的非金属性大于碳元素
您最近一年使用:0次
解题方法
7 . 下列每一序号代表一种元素。元素①是常见的过渡元素,其氧化物为黑色且具有磁性。元素②~⑤的性质如表1和元素⑥~⑩在周期表中的位置如表2所示。请回答下列有关问题:
表1

(1)元素⑤的简单离子的结构示意图是_ ;所给元素中,其含氧化合物能用于漂白,该元素可能是_ (填元素符号)。
(2)元素④在元素周期表中的位置是___ ,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为_____ 。
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为______ 。
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为___ 。
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为__ (填化学式)。设计实验证明单质氧化性顺序为⑩>⑧____ 。
元素序号 | ② | ③ | ④ | ⑤ |
原子半径/pm | 130 | 118 | 75 | 73 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |

(1)元素⑤的简单离子的结构示意图是
(2)元素④在元素周期表中的位置是
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为
您最近一年使用:0次
2020-07-23更新
|
27次组卷
|
2卷引用:山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题
解题方法
8 . 下列说法正确的是
| A.氯化钠熔化时克服离子键,碘升华克服共价键 |
| B.HF分子很稳定是由于HF分子之间能形成氢键 |
| C.一氯甲烷只有一种空间结构,证明甲烷是正四面体的空间结构而不是平面结构 |
| D.分子式为C5H12O且能与钠反应的有机物的同分异构体有8种 |
您最近一年使用:0次
9 . 下表列出了9种元素在元素周期表中的位置示意。
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________ ,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
| 周期 | ⅠA 1 | 0 18 | ||||||
| 1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ | |||||||
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
2020-01-26更新
|
189次组卷
|
2卷引用:山东省济宁市2019-2020学年高一上学期期末考试化学试题
名校
解题方法
10 . (I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:

(1)仪器A的名称是________ ,应盛放下列药品中的__________ 。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________ ,应盛放下列药品中的__________ 。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________ ,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________ 。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________ ,
②既存在离子键又存在极性键的是__________________ 。

(1)仪器A的名称是
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:
H2S:
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是
②既存在离子键又存在极性键的是
您最近一年使用:0次



