名校
1 . 下列说法中正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
B.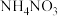 晶体中含共价键,是共价化合物 晶体中含共价键,是共价化合物 |
C.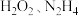 分子中只含有共价键 分子中只含有共价键 |
| D.某化合物在水溶液中能导电,可以证明该化合物内一定存在离子键 |
您最近一年使用:0次
2022-05-23更新
|
238次组卷
|
9卷引用:2015-2016学年四川省资阳市高一下学期期末化学试卷
2015-2016学年四川省资阳市高一下学期期末化学试卷四川省自贡市田家炳中学2021届高三上学期开学考试化学试题四川省成都外国语学校2020-2021学年高一下学期第三次(6月)月考化学试题(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东师范大学附属中学2021-2022学年高一下学期期中考试(等级考)化学试题浙江省舟山市普陀中学2021-2022学年高一下学期6月月考化学试题(已下线)专题五 元素周期律 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)【2022】【高二上】【期中考】【高中化学】61(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构
2 . 下表为元素周期表的短周期区域一部分,回答下列问题:
(1)⑤的简单离子结构示意图为 ,此元素在周期表中的位置为
,此元素在周期表中的位置为________ ,同主族元素中,非金属性强于此元素的有___________ (填元素符号)。
(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程__________ 。
(3)②、③、④元素的简单离子半径由大到小的顺序为_________ (填离子符号)。
(4)由③、④组成的化合物中可能含有化学键的类型为_______________ 。
(5)②与③的简单氢化物稳定性更强的是_______ (填化学式)。
(6)设计实验证明②的非金属性强于①:____________________ 。
| ① | ② | ③ | ||||
| ④ | ⑤ |
 ,此元素在周期表中的位置为
,此元素在周期表中的位置为(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程
(3)②、③、④元素的简单离子半径由大到小的顺序为
(4)由③、④组成的化合物中可能含有化学键的类型为
(5)②与③的简单氢化物稳定性更强的是
(6)设计实验证明②的非金属性强于①:
您最近一年使用:0次
解题方法
3 . 下列每一序号代表一种元素。元素①是常见的过渡元素,其氧化物为黑色且具有磁性。元素②~⑤的性质如表1和元素⑥~⑩在周期表中的位置如表2所示。请回答下列有关问题:
表1

(1)元素⑤的简单离子的结构示意图是_ ;所给元素中,其含氧化合物能用于漂白,该元素可能是_ (填元素符号)。
(2)元素④在元素周期表中的位置是___ ,该元素的氢化物与元素⑤的单质在高温催化剂条件下反应的化学方程式为_____ 。
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为______ 。
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为___ 。
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为__ (填化学式)。设计实验证明单质氧化性顺序为⑩>⑧____ 。
元素序号 | ② | ③ | ④ | ⑤ |
原子半径/pm | 130 | 118 | 75 | 73 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |

(1)元素⑤的简单离子的结构示意图是
(2)元素④在元素周期表中的位置是
(3)元素③的单质与元素①的磁性氧化物在高温条件下发生反应的化学方程式为
(4)元素⑥的单质在元素⑤的单质中燃烧的产物含有的化学键为
(5)元素⑦ 、⑧、⑨的氢化物的稳定性由弱到强的顺序为
您最近一年使用:0次
2020-07-23更新
|
27次组卷
|
2卷引用:山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题
4 . 下表列出了9种元素在元素周期表中的位置示意。
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________ ,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
| 周期 | ⅠA 1 | 0 18 | ||||||
| 1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ | |||||||
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
2020-01-26更新
|
189次组卷
|
2卷引用:山东省济宁市2019-2020学年高一上学期期末考试化学试题
5 . 现有部分元素的性质与原子(或分子)结构如下表:
请根据表中信息回答下列问题
(1)元素T在周期表中位于第_____ 周期第_____ 族
(2)元素T与X相比,原子半径较大的是________ (用元素符号表示);
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为_________ 该化合物与水反应方程式:_____________________
(4)元素Y与元素Z相比,金属性较强的是________ (用元素符号表示);
下列表述中能证明这一事实的是________ (填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:____________________________________________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
(1)元素T在周期表中位于第
(2)元素T与X相比,原子半径较大的是
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,
该化合物的电子式为
(4)元素Y与元素Z相比,金属性较强的是
下列表述中能证明这一事实的是
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:
您最近一年使用:0次
名校
6 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3包括以下两个反应:
①11KClO3+6I2+3H2O == 6KH(IO3)2 +3Cl2↑+5KCl
②KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是( )
①11KClO3+6I2+3H2O == 6KH(IO3)2 +3Cl2↑+5KCl
②KH(IO3)2+KOH==2KIO3+H2O
下列说法正确的是( )
| A.化合物KH(IO3)2中含有共价键、离子键和氢键等化学键 |
| B.反应①中每转移4mol电子生成2.24LCl2 |
| C.向淀粉溶液中加入少量碘盐,溶液会变蓝 |
| D.可用焰色反应实验证明碘盐中含有钾元素 |
您最近一年使用:0次
2019-05-26更新
|
742次组卷
|
4卷引用:山东省淄博市第十中学2020届高三上学期期末考试化学试题
名校
7 . 在高锰酸钾固体上滴加浓盐酸,马上产生黄绿色气体。反应的化学方程式为:2KMnO4 + 16HCl=2KC1 + 2MnCl2 + 5C12↑+ 8H2O
回答下列问题:
(1)此反应中的氧化剂是____ ,当在标准状况下产生0.112L氯气,转移的电子数为____ mol。
(2)氯原子的核电荷数为______ ;氧原子的原子结构示意图_______ 。
(3)在KC1固体中存在的化学键是__________ ;写出H2O电子式_________ 。
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是_________ 。
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。_________ 。
回答下列问题:
(1)此反应中的氧化剂是
(2)氯原子的核电荷数为
(3)在KC1固体中存在的化学键是
(4)工业上用氯气与消石灰作原料制造漂粉精,此反应的化学方程式是
(5)浓盐酸的溶质是氯化氢,用一个实验证明氯化氢极易溶于水。
您最近一年使用:0次
名校
8 . (1)请用下列4种物质的序号填空:①O2 ②NH4NO3 ③K2O2 ④NH3,既有离子键又有极性键的是___________ 。(填序号)
(2)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是___________ (填“共价化合物”或“离子化合物”),设计实验证明你的判断正确的实验依据是________________ 。
(3)现有a~g7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
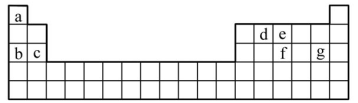
①元素的原子间反应最容易形成离子键的是___________ 。
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子___________ (填“是”或“不是”)都满足最外层为8电子结构。
(4)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的1/2。请回答下列问题:
①写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________ ,其晶体中所含化学键的类型有________ 。
②A2B与A2D的沸点:A2B________ A2D(填“高于”或“低于”),其原因是____________ 。
③由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:____________________________ 。
④碳元素的一种同位素可测定文物年代,这种同位素的符号是________ 。
(2)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是
(3)现有a~g7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子
(4)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的1/2。请回答下列问题:
①写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:
②A2B与A2D的沸点:A2B
③由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:
④碳元素的一种同位素可测定文物年代,这种同位素的符号是
您最近一年使用:0次
名校
9 . 下列说法中正确的是
| A.含有共价键的化合物一定是共价化合物 | B.在共价化合物中可能含有离子键 |
| C.含有离子键的化合物一定是离子化合物 | D.单质分子中一定含有非极性共价键 |
您最近一年使用:0次
2021-09-30更新
|
117次组卷
|
2卷引用:江西省九江第一中学2020-2021学年高二上学期入学考试化学试题
名校
解题方法
10 . 二茂铁 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
 的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是
的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法不正确的是| A.二茂铁属于分子晶体 |
B.在二茂铁中,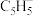 与 与 之间形成的化学键类型是离子键 之间形成的化学键类型是离子键 |
C.已知环戊二烯的结构式为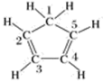 ,则其中仅有1个碳原子采取 ,则其中仅有1个碳原子采取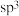 杂化 杂化 |
D.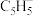 中一定含有 中一定含有 键 键 |
您最近一年使用:0次
2021-10-14更新
|
1100次组卷
|
24卷引用:福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题
福建省安溪一中、养正中学、惠安一中、泉州实验中学2016-2017学年高二下学期期末联考化学试题2017届安徽省安庆市怀宁中学等六校高三第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)福建省厦门双十中学2018-2019学年高二下学期期中考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题9-14新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期末考试化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第四次质量监测化学试题福建省龙岩第一中学2021-2022学年高二(实验班)下学期第一次月考化学试题湖北省武汉市第二中学2022届高三5月全仿真模拟考试(一)化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题全书综合测评-苏教版选择性必修2第三章 本章达标检测2山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题山东省昌乐第一中学2022-2023学年高二下学期第一次月考化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题福建省莆田第二十五中学2023-2024学年高二下学期第一次质量检化学试题



