1 . 下列说法正确的是
| A.“量子化”就是不连续的意思,微观粒子运动均有此特点 |
| B.英国科学家道尔顿首先发现了电子 |
| C.焰色反应与电子跃迁有关,属于化学变化 |
| D.基态氢原子转变成激发态氢原子时释放能量 |
您最近一年使用:0次
2020-04-03更新
|
114次组卷
|
3卷引用:山东省威海市文登区2018-2019学年高二下学期期末考试化学试题
11-12高三上·上海长宁·期末
解题方法
2 . 已知某种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,X元素的原子核外共有20种不同运动状态的电子,Y元素的原子核外共有5种不同能级的电子,且XY2中阳离子和阴离子的电子层结构相同。
(1)该融雪剂的化学式是_________ ;电子式为:_________ ;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式为 ________ ;E的单质中,质软有润滑性的是___________ (填写单质名称)。
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是___________ 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为____________________________________ 。
(1)该融雪剂的化学式是
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
您最近一年使用:0次
11-12高三上·上海奉贤·期末
解题方法
3 . 工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:Na2CO3+SiO2 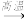 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 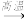 CaSiO3+CO2↑
CaSiO3+CO2↑
(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为________ ,则原料中SiO2、Na2CO3、CaCO3的物质的量之比为_________________________ 。
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式___________________ ,有_____________ 种不同类型的晶体(填数字)
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径___________ (填“大”或“小”),该元素与铝元素两者的最高价氧化物的水化物之间发生反应的离子方程式为__________________________ 。
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有________ 种不同运动状态的电子、________ 种不同能级的电子。
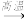 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 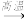 CaSiO3+CO2↑
CaSiO3+CO2↑(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有
您最近一年使用:0次
4 . 下列有关说法正确的是( )
| A.电子云通常用小黑点的疏密来表示,小黑点密表示在该空间的电子数多 |
| B.已知 Co 的价层电子排布式为 3d74s2,Co3+的价层电子排布式为3d6 |
| C.Cu 的核外电子排布为 1s22s22p63s23p63d104s1,所以 Cu 处于 s 区 |
| D.原子光谱的特征谱线用于鉴定元素,从 1s22s22p33s1跃迁至 1s22s22p4时形成是吸收光谱 |
您最近一年使用:0次
2020-03-28更新
|
194次组卷
|
5卷引用:山西省实验中学2019-2020学年高二下学期第一次月考化学试题
解题方法
5 . 下列关于原子核外电子的描述正确的是
| A.s 能级的能量总小于 p 能级的能量 |
| B.2s 的电子云半径比 1s 电子云半径大,说明 2s 的电子比 1s 的多 |
C.基态铜原子的价电子轨道表示式为  |
| D.nf 能级中最多可容纳 14 个电子 |
您最近一年使用:0次
6 . 下列叙述正确的是( )
| A.电负性的大小可以作为判断元素金属性和非金属性强弱的尺度 |
| B.在同一电子层上运动的电子,其自旋方向肯定不同 |
| C.镁原子的核外电子排布由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| D.基态原子价层电子排布是5s1的元素,其氢氧化物的溶液一定不能溶解氢氧化铝 |
您最近一年使用:0次
2020-03-26更新
|
156次组卷
|
6卷引用:2015-2016学年陕西省宝鸡市岐山县高二下期末文科化学试卷
14-15高三上·上海浦东新·阶段练习
名校
解题方法
7 . 关于硫原子核外电子的叙述错误的是( )
| A.排布在K、L、M三个电子层上 |
| B.3p亚层上有2个空轨道 |
| C.共有16种不同的运动状态 |
| D.共有5种不同的能量 |
您最近一年使用:0次
2020-03-23更新
|
150次组卷
|
3卷引用:上海市建平中学2015届高三10月月考化学试题
8 . 铅是一种金属元素,可用作耐酸腐蚀、蓄电池等的材料。其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有_______ 种能量不同的电子,其次外层的电子云有_______ 种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是______ (填化学式),气态氢化物沸点最低的是_____________ (填化学式)。
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
__ PbO2+___ MnSO4+___ HNO3 →___ HMnO4+___ Pb(NO3)2+___ PbSO4↓+____ ____
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为_______ 个。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
您最近一年使用:0次
9 . 乙烯间接水合法生产乙醇是指:先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),硫酸氢乙酯再水解生成乙醇,相应反应的化学方程式:
第一步:CH2=CH2+H2SO4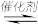 C2H5OSO3H+Q;
C2H5OSO3H+Q;
第二步:C2H5OSO3H+H2O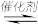 CH3CH2OH+H2SO4
CH3CH2OH+H2SO4
完成下列填空:
(1)如果要提高上述第一步反应中乙烯的转化率,可以采取的措施是_______ 。(选填编号)
a 加压 b 增加乙烯的浓度 c 升温 d 及时移走产物
(2)第一步中的浓硫酸有脱水性,写出浓硫酸使蓝色硫酸铜晶体变白色粉末的化学方程式(已知H2SO4·H2O稳定)______________ 。
(3)简述上述两步反应中循环利用的物质是_____ ,将此物质循环的操作步骤:__________ 。
(4)硫酸氢乙酯的组成元素中,元素性质相似的是_________ 。碳元素原子最外层有_______ 种运动状态不同的电子。通过比较___________ 可判断碳、氧两种元素的非金属性强弱。
(5)已知H2O2是18电子的分子,硫酸氢乙酯的组成元素中元素间也能形成18电子分子X,则X的化学式为_______ 。H2O2沸点高于X,其原因是____________ 。
第一步:CH2=CH2+H2SO4
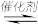 C2H5OSO3H+Q;
C2H5OSO3H+Q; 第二步:C2H5OSO3H+H2O
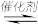 CH3CH2OH+H2SO4
CH3CH2OH+H2SO4完成下列填空:
(1)如果要提高上述第一步反应中乙烯的转化率,可以采取的措施是
a 加压 b 增加乙烯的浓度 c 升温 d 及时移走产物
(2)第一步中的浓硫酸有脱水性,写出浓硫酸使蓝色硫酸铜晶体变白色粉末的化学方程式(已知H2SO4·H2O稳定)
(3)简述上述两步反应中循环利用的物质是
(4)硫酸氢乙酯的组成元素中,元素性质相似的是
(5)已知H2O2是18电子的分子,硫酸氢乙酯的组成元素中元素间也能形成18电子分子X,则X的化学式为
您最近一年使用:0次
10 . 下列说法不正确的是( )
| A.电子构型为[Ar]3d104s2的元素是过渡金属元素 |
B.某基态原子3d能级中电子排布的情况可能为 |
| C.在氢原子的电子云图中,每个小黑点代表一个电子 |
| D.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态 |
您最近一年使用:0次



