解题方法
1 . 教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
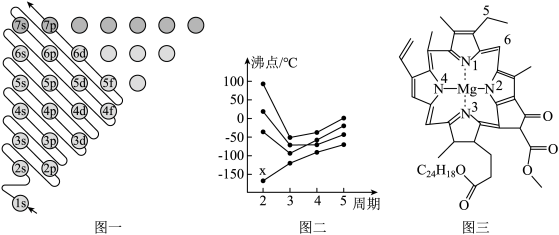
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___ 种,其中原子序数最大的基态原子的外围电子排布式为___ 。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___ ;与x点对应的简单氢化物互为等电子体的离子为___ (写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___ ;5号C原子和6号C原子的杂化方式分别为___ 、___ ;该分子中所含非金属元素的电负性由小到大的顺序为___ 。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°= ),石墨晶体的密度为
),石墨晶体的密度为___ g·cm-3(列出计算式)。

(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°=
 ),石墨晶体的密度为
),石墨晶体的密度为
您最近一年使用:0次
解题方法
2 . 化学中的某些元素与生命活动密不可分。请回答下列问题:
(1)(NH4)2SO4是一种重要的化学肥料,其中N、S原子的杂化方式分别是______ 、______ ,SO2-4的空间构型为_______________ 。
(2)钙是儿童生长不可缺少的元素,基态钙原子中,电子没有全充满的能层是________ 。
(3)蛋白质中含有N、P等元素,它们分别形成的简单气态氢化物键角大小关系是_____ (用化学式表示),原因是_________________ 。
(4)金属铁、镍及其形成的许多化合物常用作催化剂。已知NiO、FeO的晶体类型均与氯化钠晶体相同,熔点NiO>FeO,推测 Ni2+和 Fe2+离子半径的大小关系是__________ ,作出判断的依据是____________ 。
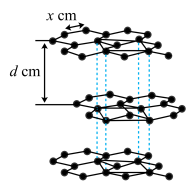
(5)某金属是抗癌药物中的明星元素,其晶体中原子的堆积方式如图所示。

晶胞中金属原子的配位数为_____ 。若已知金属的摩尔质量为M g/mol ,阿伏加德罗常数为NA,原子半径为r pm,则该晶胞的密度为 p=_____ g/ cm3。(用含M、NA、r的计算式表示,不用化简)
(1)(NH4)2SO4是一种重要的化学肥料,其中N、S原子的杂化方式分别是
(2)钙是儿童生长不可缺少的元素,基态钙原子中,电子没有全充满的能层是
(3)蛋白质中含有N、P等元素,它们分别形成的简单气态氢化物键角大小关系是
(4)金属铁、镍及其形成的许多化合物常用作催化剂。已知NiO、FeO的晶体类型均与氯化钠晶体相同,熔点NiO>FeO,推测 Ni2+和 Fe2+离子半径的大小关系是
(5)某金属是抗癌药物中的明星元素,其晶体中原子的堆积方式如图所示。

晶胞中金属原子的配位数为
您最近一年使用:0次



