解题方法
1 . 如图所示是s能级和p能级的原子轨道图:
(1)s电子的原子轨道呈___________ 形,每个s能级有___________ 个原子轨道;p电子的原子轨道呈___________ 形,每个p能级有___________ 个原子轨道。
(2)元素X的基态原子最外层电子排布式为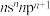 ,其p电子云在空间有3个互相
,其p电子云在空间有3个互相___________ (填“垂直”或“平行”)的伸展方向;元素X的名称是___________ ,它的最低价氢化物的电子式是___________ 。
(3)元素Y的基态原子最外层电子排布式为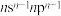 ,那么Y的元素符号应为
,那么Y的元素符号应为___________ ,其基态原子的轨道表示式为___________ 。

(1)s电子的原子轨道呈
(2)元素X的基态原子最外层电子排布式为
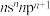 ,其p电子云在空间有3个互相
,其p电子云在空间有3个互相(3)元素Y的基态原子最外层电子排布式为
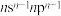 ,那么Y的元素符号应为
,那么Y的元素符号应为
您最近半年使用:0次
2 . 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。试回答下列问题:
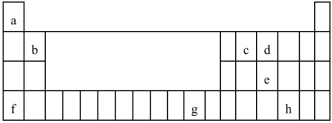
(1)基态f原子中,其占据的最高能层的符号是___________ 。
(2)元素a、c、d以原子个数比1∶1∶1形成的分子的电子式为___________ 。
(3)元素h的基态原子的价电子排布式为___________ 。
(4)元素g的基态g+核外电子的空间运动状态有___________ 种。
(5)某些不同族的元素因电负性相近,其性质也有一定的相似性。如元素b的最高价氧化物对素应的水化物和f的最高价氧化物对应的水化物能相互反应,其离子方程式是___________ 。

(1)基态f原子中,其占据的最高能层的符号是
(2)元素a、c、d以原子个数比1∶1∶1形成的分子的电子式为
(3)元素h的基态原子的价电子排布式为
(4)元素g的基态g+核外电子的空间运动状态有
(5)某些不同族的元素因电负性相近,其性质也有一定的相似性。如元素b的最高价氧化物对素应的水化物和f的最高价氧化物对应的水化物能相互反应,其离子方程式是
您最近半年使用:0次
名校
解题方法
3 . 回答下列问题
(1)基态硫原子电子占据的最高能层符号为______ ,核外有______ 种能量不同的电子,硫原子核外电子有______ 种空间运动状态。
(2)与S同主族,位于第四周期的元素的符号是______ ,其价电子排布式为______
(3)已知有下列转化:
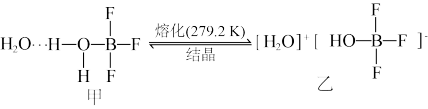
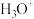 的VSEPR模型为
的VSEPR模型为______ 。化合物乙中微粒间不存在的化学键有______ (填序号)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(4)相同条件下 与
与 分子在水中的溶解度较大的是
分子在水中的溶解度较大的是______ (写分子式),理由是______ 。 中的
中的 键角
键角______ (填“>”“<”或“=”) 中的
中的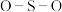 键角。
键角。
(5)已知 是直线形分子,且有对称性,则
是直线形分子,且有对称性,则 分子的结构式为
分子的结构式为______ ,其中 键与
键与 键的个数比为
键的个数比为______ 。
(1)基态硫原子电子占据的最高能层符号为
(2)与S同主族,位于第四周期的元素的符号是
(3)已知有下列转化:
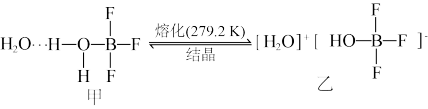
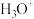 的VSEPR模型为
的VSEPR模型为A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(4)相同条件下
 与
与 分子在水中的溶解度较大的是
分子在水中的溶解度较大的是 中的
中的 键角
键角 中的
中的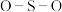 键角。
键角。(5)已知
 是直线形分子,且有对称性,则
是直线形分子,且有对称性,则 分子的结构式为
分子的结构式为 键与
键与 键的个数比为
键的个数比为
您最近半年使用:0次
名校
解题方法
4 . A、B、C、D、 E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为___________ 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为___________ ,C的元素符号为___________ 。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为___________
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为___________
(5)F元素的原子最外层电子排布式为nsnnpn+2,则n=___________ ;原子中能量最高的是___________ 电子。
(6)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ ,___________ (填标号)
A.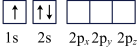 B.
B.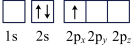 C.
C.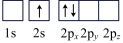 D.
D.
(7)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___________ ,某原子的电子排布式为 [Ne]3s23p1,则该原子的元素符号为___________ ,最高正价为___________ ,该原子位于元素周期表第___________ 周期第___________ 族,位于元素周期表___________ 区。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为
(5)F元素的原子最外层电子排布式为nsnnpn+2,则n=
(6)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B. C.
C. D.
D.
(7)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是
您最近半年使用:0次
名校
解题方法
5 . 有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1)D是___________ (填元素名称), D的基态原子中,电子占据的最高能层符号为___________ ,该能层具有的原子轨道数为___________
(2) 若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl﹣取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为___________ (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(3)元素E所在的周期,未成对电子数最多的元素是___________ (填元素符号)
(4)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是___________

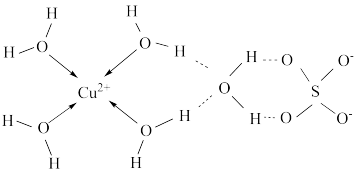
(5)向溶液中滴加氨水,首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,加入乙醇后析出深蓝色晶体。请写出氨水过量后沉淀逐渐溶解的离子方程式:___________ 。
(6)科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为___________ 。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
请回答下列问题。
(1)D是
(2) 若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl﹣取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(3)元素E所在的周期,未成对电子数最多的元素是
(4)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(5)向溶液中滴加氨水,首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,加入乙醇后析出深蓝色晶体。请写出氨水过量后沉淀逐渐溶解的离子方程式:
(6)科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为

您最近半年使用:0次
解题方法
6 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D,B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属于同一周期,两者可以形成许多种共价化合物,C、F属于同一主族,B原子最外电子层的p能级上的电子处于半充满状态,C的最外层电子数是内层电子数的3倍,E的最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素基态原子电子排布式为__ 。
(2)F元素基态原子的价电子轨道表示式为__ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为__ 。
(4)A、C形成的两种常见分子中,其中一种为绿色氧化剂,电子式为__ 。
(5)基态G原子中,电子占据的最高电子层符号是__ ,该电子层有__ 个能级,电子数是__ 。该原子有__ 种运动状态不同的电子,最高能级符号是__ ,未成对电子数为__ 。
(6)与E同族且有4个电子层的元素的符号为__ ,它的简化电子排布式为__ ,与该元素同周期且核电荷数比该元素小7的元素在周期表中的位置是__ ,该元素基态原子的价电子排布式为__ ,__ (填“满足”或“不满足”)构造原理。
(1)E元素基态原子电子排布式为
(2)F元素基态原子的价电子轨道表示式为
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为
(4)A、C形成的两种常见分子中,其中一种为绿色氧化剂,电子式为
(5)基态G原子中,电子占据的最高电子层符号是
(6)与E同族且有4个电子层的元素的符号为
您最近半年使用:0次
7 . 按要求回答下列问题:
(1)某元素原子的价电子排布式为3d14s2,元素符号为________ ,最高正化合价为________ 。
(2)原子序数为26的元素的原子中有________ 个能级,________ 个未成对电子,________ 种运动状态不同的电子,位于________ 族________ 区,该原子的原子结构示意图为________ 。
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为________ ,其能量最高的电子的电子云在空间有________ 个方向,原子轨道呈________ 形。
(4)请写出次外层电子数是最外层电子数 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:____________ 。
(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是________ 。
(1)某元素原子的价电子排布式为3d14s2,元素符号为
(2)原子序数为26的元素的原子中有
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为
(4)请写出次外层电子数是最外层电子数
 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是
您最近半年使用:0次
解题方法
8 . 教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
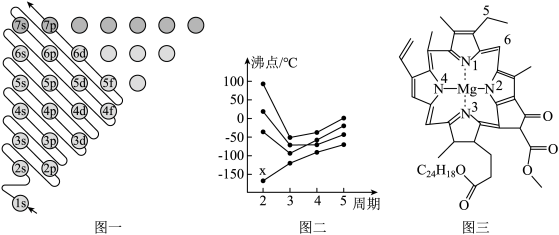
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___ 种,其中原子序数最大的基态原子的外围电子排布式为___ 。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___ ;与x点对应的简单氢化物互为等电子体的离子为___ (写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___ ;5号C原子和6号C原子的杂化方式分别为___ 、___ ;该分子中所含非金属元素的电负性由小到大的顺序为___ 。
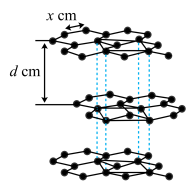
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°= ),石墨晶体的密度为
),石墨晶体的密度为___ g·cm-3(列出计算式)。

(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°=
 ),石墨晶体的密度为
),石墨晶体的密度为
您最近半年使用:0次
解题方法
9 . 由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为__ 个,能量最高的电子占据的能级符号为___ 。
(2)磷的一种同素异形体—白磷(P4)的立体构型为__ ,推测其在CS2中的溶解度__ (填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:__ 。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:___ 。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为__ ,已知晶体的密度为ρg·cm-3,阿伏加 德罗常数为NA,则晶胞边长为__ cm(用含ρ、NA的式子表示)。

(1)钛元素基态原子未成对电子数为
(2)磷的一种同素异形体—白磷(P4)的立体构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为

您最近半年使用:0次
名校
解题方法
10 . 铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(l)基态铁原子的价电子轨道表达式(电子排布图)为____________________________ ;在基态Ti2+中,电子占据的最高能层具有的原子轨道数为____________ 。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+___ Fe3+(填“大于”或“小于”),原因是___________ 。
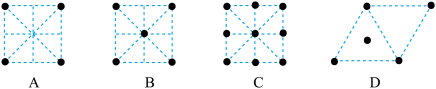
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)______________ 。
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为___________ 。
(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为__________ ;
Ti原子与跟它次邻近的N原子之间的距离为____________ 。
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为____________ 。(用a、b表示)
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____________________ 。
(l)基态铁原子的价电子轨道表达式(电子排布图)为
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为

(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。

①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为
Ti原子与跟它次邻近的N原子之间的距离为
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为
您最近半年使用:0次



