1 . 炭粉、CO、H2均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行探究。
查阅资料: PdCl2溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
回答下列问题:
(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为___________ 。
A.577~492 nm B.597~577 nm C. 622~597 nm
(2)基态Cu+的价电子轨道表示式为___________ 。
(3)小组同学用如图所示装置探究炭粉与CuO反应的产物。
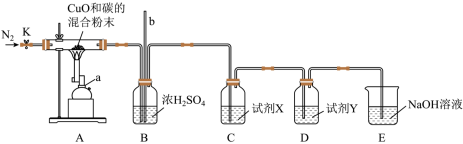
①实验结束后,打开开关K通氮气,其目的是___________ 。
②试剂X的作用为___________ 。
③若气体产物中含有CO,则观察到的现象为______ , 其中反应的化学方程式为_______ 。
(4)某小组同学为测定炭粉还原CuO后固体混合物(仅有C和Cu2O)两种杂质)中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸(恰好使固体溶解达到最大值),过滤、洗涤、干燥,所得沉淀的质量为0.160g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25. 00 mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.5000 mol· L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12. 00 mL。已知:2Cu2++5I-=2CuI↓ + ,
, +2
+2 =
=  +3I-。
+3I-。
①还原后固体混合物中单质Cu的质量分数为___________ %。
②若CuI吸附部分 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数___________ (填“偏大”、“偏小”或“无影响”)。
查阅资料: PdCl2溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
回答下列问题:
(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为
A.577~492 nm B.597~577 nm C. 622~597 nm
(2)基态Cu+的价电子轨道表示式为
(3)小组同学用如图所示装置探究炭粉与CuO反应的产物。

①实验结束后,打开开关K通氮气,其目的是
②试剂X的作用为
③若气体产物中含有CO,则观察到的现象为
(4)某小组同学为测定炭粉还原CuO后固体混合物(仅有C和Cu2O)两种杂质)中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸(恰好使固体溶解达到最大值),过滤、洗涤、干燥,所得沉淀的质量为0.160g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25. 00 mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.5000 mol· L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12. 00 mL。已知:2Cu2++5I-=2CuI↓ +
 ,
, +2
+2 =
=  +3I-。
+3I-。①还原后固体混合物中单质Cu的质量分数为
②若CuI吸附部分
 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数
您最近一年使用:0次
解题方法
2 . 实验室利用钴渣[含 、
、 等]制备磁性材料
等]制备磁性材料 。
。
(1)浸取。将一定量的钴渣粉与 、
、 溶液中的一种配成悬浊液,加入到三颈瓶中(装置如图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是
溶液中的一种配成悬浊液,加入到三颈瓶中(装置如图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是___________ ; 转化为
转化为 的离子方程式为
的离子方程式为___________ 。

(2)沉钴。Co(II)盐溶液可以 、
、 和
和 等多种形式沉淀。
等多种形式沉淀。
已知:向 溶液中滴加NaOH溶液调节pH,pH=7时开始出现
溶液中滴加NaOH溶液调节pH,pH=7时开始出现 沉淀。向除杂后
沉淀。向除杂后 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 。
。
①基态 的价电子排布式为
的价电子排布式为___________ ;
②不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是___________ 。
(3)制备 。以
。以 为原料先制得
为原料先制得 ;然后再制备
;然后再制备 。
。
已知:①尿素水溶液呈弱碱性,70℃以上能缓慢水解产生 ,pH为1~3时水解速率对生成
,pH为1~3时水解速率对生成 沉淀较为适宜。
沉淀较为适宜。
②取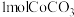 在空气中加热,反应温度对反应产物的影响如图所示。
在空气中加热,反应温度对反应产物的影响如图所示。

请补充完整以 溶液、尿素、稀硫酸、蒸馏水为原料,制备
溶液、尿素、稀硫酸、蒸馏水为原料,制备 的实验方案:取一定体积
的实验方案:取一定体积 溶液,
溶液,___________ ;充分反应,___________ ;反应至固体质量不再变化,即可制得 。
。
(4)利用该工艺制成的改性 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置并说明理由:
所在晶胞的位置并说明理由:___________ 。

 、
、 等]制备磁性材料
等]制备磁性材料 。
。(1)浸取。将一定量的钴渣粉与
 、
、 溶液中的一种配成悬浊液,加入到三颈瓶中(装置如图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是
溶液中的一种配成悬浊液,加入到三颈瓶中(装置如图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是 转化为
转化为 的离子方程式为
的离子方程式为
(2)沉钴。Co(II)盐溶液可以
 、
、 和
和 等多种形式沉淀。
等多种形式沉淀。已知:向
 溶液中滴加NaOH溶液调节pH,pH=7时开始出现
溶液中滴加NaOH溶液调节pH,pH=7时开始出现 沉淀。向除杂后
沉淀。向除杂后 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 。
。①基态
 的价电子排布式为
的价电子排布式为②不能用同浓度的
 溶液代替
溶液代替 溶液的原因是
溶液的原因是(3)制备
 。以
。以 为原料先制得
为原料先制得 ;然后再制备
;然后再制备 。
。已知:①尿素水溶液呈弱碱性,70℃以上能缓慢水解产生
 ,pH为1~3时水解速率对生成
,pH为1~3时水解速率对生成 沉淀较为适宜。
沉淀较为适宜。②取
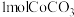 在空气中加热,反应温度对反应产物的影响如图所示。
在空气中加热,反应温度对反应产物的影响如图所示。
请补充完整以
 溶液、尿素、稀硫酸、蒸馏水为原料,制备
溶液、尿素、稀硫酸、蒸馏水为原料,制备 的实验方案:取一定体积
的实验方案:取一定体积 溶液,
溶液, 。
。(4)利用该工艺制成的改性
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置并说明理由:
所在晶胞的位置并说明理由:
您最近一年使用:0次
3 . 三氯化铬( )是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
)是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。

已知: 沸点为8.2℃,有毒,易水解
沸点为8.2℃,有毒,易水解
回答下列问题:
(1)基态铬原子核外电子排布式为_____ ,三氯化铬固体的晶体类型为_____
(2)“热分解”发生反应的化学方程式为_____
(3)“热反应”制无水 的实验装置如图所示(AD中加热装置略)。
的实验装置如图所示(AD中加热装置略)。

①实验装置连接顺序为_____ 。
b→_____,_____→_____,_____→_____,_____→_____(填仪器接口字母)
②加热反应前通 的目的是
的目的是_____ 。
③A中仪器x的名称是_____ ,其作用是_____ 。
④E中收集的物质含有_____ (写化学式)。
⑤尾气经_____ 处理后可循环使用。
(4)已知 配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.87g白色沉淀。
溶液,得到2.87g白色沉淀。
① 中存在的化学键有
中存在的化学键有_____ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为_____ 。
 )是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
)是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
已知:
 沸点为8.2℃,有毒,易水解
沸点为8.2℃,有毒,易水解回答下列问题:
(1)基态铬原子核外电子排布式为
(2)“热分解”发生反应的化学方程式为
(3)“热反应”制无水
 的实验装置如图所示(AD中加热装置略)。
的实验装置如图所示(AD中加热装置略)。
①实验装置连接顺序为
b→_____,_____→_____,_____→_____,_____→_____(填仪器接口字母)
②加热反应前通
 的目的是
的目的是③A中仪器x的名称是
④E中收集的物质含有
⑤尾气经
(4)已知
 配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.87g白色沉淀。
溶液,得到2.87g白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近一年使用:0次
2023-08-30更新
|
661次组卷
|
4卷引用:考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)福建省泉州市普通高中毕业班2024届高三质量检测(一)(8月)化学试题新疆阿克苏市实验中学2023-2024学年高三上学期第二次月考化学试题
名校
4 . 铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
i.FeSO4·H2O结构如图所示:

(1)Fe2+价层电子排布式为_______ 。
(2)比较 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
(3) 与
与 和
和 的作用分别为
的作用分别为_______ 。
ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol•L−1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol∙L−1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。

①三颈烧瓶发生反应的离子方程式为_______ 。
②检验反应是否进行完全的操作是_______ 。
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是_______ 。
②计算实验所得产品的产率_______ (写出计算过程)。
(6)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3。已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下_______ ,将固体干燥,得到纯净的 FeCO3,将其放入管式炉内煅烧 2h,获得产品α−Fe2O3 (可选用的试剂:氨水−NH4HCO3混合溶液、2mol•L−1盐酸、2mol•L−1硝酸、AgNO3溶液、蒸馏水)。
i.FeSO4·H2O结构如图所示:

(1)Fe2+价层电子排布式为
(2)比较
 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:(3)
 与
与 和
和 的作用分别为
的作用分别为ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol•L−1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol∙L−1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。

①三颈烧瓶发生反应的离子方程式为
②检验反应是否进行完全的操作是
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是
②计算实验所得产品的产率
(6)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3。已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下
您最近一年使用:0次
2022-08-15更新
|
575次组卷
|
3卷引用:易错点06 铁及其化合物-备战2023年高考化学考试易错题



