名校
解题方法
1 . 三氯化铬( )为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。_______ 。
②实验前先往装置A中通入 ,其目的是排尽装置中的空气,在实验过程中还需要持续通入
,其目的是排尽装置中的空气,在实验过程中还需要持续通入 ,其作用是
,其作用是_____________________ 。
③装置C的水槽中应盛有_______ (填“冰水”或“沸水”)。
④装置B中还会生成光气( ),B中反应的化学方程式为
),B中反应的化学方程式为_____________________ 。
(2) 的工业制法:先用40%的NaOH将红矾钠(
的工业制法:先用40%的NaOH将红矾钠( )转化为铬酸钠(
)转化为铬酸钠( ),加入过量
),加入过量 ,再加入10%HCl溶液,可以看到有气泡产生。写出用
,再加入10%HCl溶液,可以看到有气泡产生。写出用 将铬酸钠(
将铬酸钠( )还原为
)还原为 的离子方程式
的离子方程式_____________________ 。
(3)为进一步探究 的性质,某同学取试管若干支,分别加入10滴
的性质,某同学取试管若干支,分别加入10滴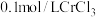 溶液,并用4滴
溶液,并用4滴 酸化,再分别加入不同滴数的0.1mol/L
酸化,再分别加入不同滴数的0.1mol/L 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。
①温度对反应的影响。
 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是_______________ ,所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
② 与
与 的用量对反应的影响。
的用量对反应的影响。
对表中数据进行分析,在上述反应条件下,欲将 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为________ 。这与由反应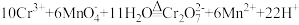 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是_____________ 。
 )为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
)为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)某化学小组用
 和
和 在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有
在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有 ,其沸点为76.8℃。
,其沸点为76.8℃。
②实验前先往装置A中通入
 ,其目的是排尽装置中的空气,在实验过程中还需要持续通入
,其目的是排尽装置中的空气,在实验过程中还需要持续通入 ,其作用是
,其作用是③装置C的水槽中应盛有
④装置B中还会生成光气(
 ),B中反应的化学方程式为
),B中反应的化学方程式为(2)
 的工业制法:先用40%的NaOH将红矾钠(
的工业制法:先用40%的NaOH将红矾钠( )转化为铬酸钠(
)转化为铬酸钠( ),加入过量
),加入过量 ,再加入10%HCl溶液,可以看到有气泡产生。写出用
,再加入10%HCl溶液,可以看到有气泡产生。写出用 将铬酸钠(
将铬酸钠( )还原为
)还原为 的离子方程式
的离子方程式(3)为进一步探究
 的性质,某同学取试管若干支,分别加入10滴
的性质,某同学取试管若干支,分别加入10滴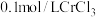 溶液,并用4滴
溶液,并用4滴 酸化,再分别加入不同滴数的0.1mol/L
酸化,再分别加入不同滴数的0.1mol/L 溶液,并在不同的温度下进行实验,反应现象记录于表中。
溶液,并在不同的温度下进行实验,反应现象记录于表中。 的用量(滴数) 的用量(滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90-100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~9 | 紫红色 | 黄绿色溶液,且随 滴数增加,黄色成分增多 滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随 滴数增加,沉淀增多 滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
 与
与 在常温下反应,观察不到
在常温下反应,观察不到 离子的橙色,甲同学认为其中一个原因是
离子的橙色,甲同学认为其中一个原因是 离子的橙色被
离子的橙色被 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是②
 与
与 的用量对反应的影响。
的用量对反应的影响。对表中数据进行分析,在上述反应条件下,欲将
 氧化为
氧化为 ,
, 与
与 最佳用量比为
最佳用量比为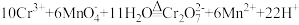 所推断得到的用量比不符,你推测的原因是
所推断得到的用量比不符,你推测的原因是
您最近一年使用:0次
2022-12-20更新
|
1506次组卷
|
9卷引用:河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)广东省六校2023届高三第三次联考化学试题广东省六校联盟2022-2023学年高三上学期第三次联考化学试题福建省厦门外国语学校2023届高三上学期期末检测化学试题湖南省娄底市部分学校2022-2023学年高三三模化学试题辽宁省锦州市渤海大学附属高级中学2023届高三下学期第六次模拟考试化学试题广东省广州市第二中学等五校2022-2023学年高三上学期12月月考化学试题(已下线)T17-实验综合题湖南省2024届高三下学期高考仿真模拟卷(四)化学试题
名校
2 . 银器、银质首饰等是生活中常见物品。某小组以废定影液[主要成分为Na3[Ag(S2O3)2]制备Ag。

请回答下列问题:
(1)银位于周期表第5周期第I B族,基态银原子价层电子排布式为_______ 。
(2)提高“焙烧”中反应速率,宜采取的措施有_______ (答两条)。
(3)“酸溶”中可以适当加热,提高反应速率,但是温度过高,反应速率会降低,其主要原因可能是_______ 。
(4)25°C,滤液2的pH_______ 7(填“>”“<”或“=”)。
(5)“沉银1”发生的反应为2[Ag(S2O3)2]3- (aq)+S2-(aq) Ag2S(s)+4
Ag2S(s)+4 (aq),平衡常数K=
(aq),平衡常数K=_______ 。
已知:Ksp(Ag2S)≈1.0×10-50,Ag+ (aq)+ 2 (aq)
(aq)  [ Ag(S2O3)2]3- (aq),K稳≈1.0×10l3(K稳表示配离子的稳定常数)。
[ Ag(S2O3)2]3- (aq),K稳≈1.0×10l3(K稳表示配离子的稳定常数)。
(6)采用电化学原理提纯银和处理银首饰(粗银含铜、锌和金等杂质)。
①工业上,用电解法提纯银,装置如图。一段时间后,U形管中c(AgNO3)会_______ (填“ 增大”“减小”或“不变”)。

②生活中银器、银首饰变暗的原因是银与空气接触时硫化氢和氧气参与反应,生成黑色Ag2S。恢复方法是:将变暗的银首饰等浸入盛装饱和食盐水的铝盆一段时间,银首饰“光亮如初”,其原理是: 2Al+3Ag2S+6H2O=2Al(OH)3 +6Ag+3H2S↑,正极的反应式为_______ 。

请回答下列问题:
(1)银位于周期表第5周期第I B族,基态银原子价层电子排布式为
(2)提高“焙烧”中反应速率,宜采取的措施有
(3)“酸溶”中可以适当加热,提高反应速率,但是温度过高,反应速率会降低,其主要原因可能是
(4)25°C,滤液2的pH
(5)“沉银1”发生的反应为2[Ag(S2O3)2]3- (aq)+S2-(aq)
 Ag2S(s)+4
Ag2S(s)+4 (aq),平衡常数K=
(aq),平衡常数K=已知:Ksp(Ag2S)≈1.0×10-50,Ag+ (aq)+ 2
 (aq)
(aq)  [ Ag(S2O3)2]3- (aq),K稳≈1.0×10l3(K稳表示配离子的稳定常数)。
[ Ag(S2O3)2]3- (aq),K稳≈1.0×10l3(K稳表示配离子的稳定常数)。(6)采用电化学原理提纯银和处理银首饰(粗银含铜、锌和金等杂质)。
①工业上,用电解法提纯银,装置如图。一段时间后,U形管中c(AgNO3)会

②生活中银器、银首饰变暗的原因是银与空气接触时硫化氢和氧气参与反应,生成黑色Ag2S。恢复方法是:将变暗的银首饰等浸入盛装饱和食盐水的铝盆一段时间,银首饰“光亮如初”,其原理是: 2Al+3Ag2S+6H2O=2Al(OH)3 +6Ag+3H2S↑,正极的反应式为
您最近一年使用:0次
2023-02-11更新
|
250次组卷
|
3卷引用:河南省焦作市博爱县第一中学2022-2023学年高三下学期5月月考化学试题



