1 . X、Y、Z、W均为短周期元素,原子序数依次递增。Y是地壳中含量最高的元素,Z原子在元素周期表中的周期序数等于族序数,Z的简单阳离子与 含有相同的电子数,W原子最高能级和最低能级填充电子的数目相等,下列说法正确的是
含有相同的电子数,W原子最高能级和最低能级填充电子的数目相等,下列说法正确的是
 含有相同的电子数,W原子最高能级和最低能级填充电子的数目相等,下列说法正确的是
含有相同的电子数,W原子最高能级和最低能级填充电子的数目相等,下列说法正确的是A.电负性: |
B.第一电离能: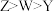 |
| C.工业上常用电解法制备元素Z的单质 |
| D.Z的最高价氧化物的水化物可溶于W的最高价氧化物的水化物 |
您最近一年使用:0次
2022-08-22更新
|
106次组卷
|
2卷引用:2.2.2元素第一电离能和电负性的周期性变化 课后
2 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①元素:A_______ 、B_______ 、C_______ 、D______ 、E______ 、F______ 。
②A、B、C三种元素的电负性大小顺序是:___________ 。
③B、C、D、E四种元素的第一电离能大小顺序是:___________ 。
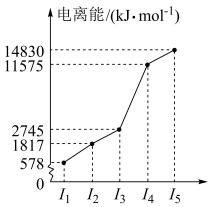
(2)如图是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。F元素位于周期表的___________ 区,此区元素的价电子层结构特点是___________ 。
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①元素:A
②A、B、C三种元素的电负性大小顺序是:
③B、C、D、E四种元素的第一电离能大小顺序是:
(2)如图是A~F元素中某种元素的部分电离能,由此可判断该元素是

您最近一年使用:0次
2021-12-03更新
|
1611次组卷
|
3卷引用:人教2019选择性必修2第一章 原子结构与性质复习与提高
3 . A、B、C、D四种元素,已知A是地壳中含量最多的元素;B为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C是第3周期第一电离能最小的元素,D是第3周期第一电离能最大的元素。下列有关叙述错误的是
| A.A、B、C、D分别为O、Ca、Na、Ar |
| B.A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 |
| C.A、C简单离子的半径:A<C |
| D.B的基态原子的电子排布式为1s22s22p63s23p64s2 |
您最近一年使用:0次
2021-02-16更新
|
327次组卷
|
2卷引用:(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 章末总结
名校
解题方法
4 . 如图为周期表的一小部分, A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐增大 |
| B.B元素最高价氧化物对应的水化物是强酸 |
| C.A元素是空气中含量最多的元素 |
D.简单气态氢化物的稳定性: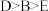 |
您最近一年使用:0次
2021-02-06更新
|
321次组卷
|
3卷引用:高二选择性必修2(人教版2019)第一章 原子结构与性质 第一章素养检测
5 .  、
、 、
、 、
、 四种元素,已知
四种元素,已知 元素是地壳中含量最多的元素;
元素是地壳中含量最多的元素; 元素为金属元素,它的原子核外
元素为金属元素,它的原子核外 、
、 层电子数之和等于
层电子数之和等于 、
、 层电子数之和;
层电子数之和; 元素是第三周期中第一电离能最小的元素;
元素是第三周期中第一电离能最小的元素; 元素在第三周期中第一电离能最大。下列有关叙述错误的是
元素在第三周期中第一电离能最大。下列有关叙述错误的是
 、
、 、
、 、
、 四种元素,已知
四种元素,已知 元素是地壳中含量最多的元素;
元素是地壳中含量最多的元素; 元素为金属元素,它的原子核外
元素为金属元素,它的原子核外 、
、 层电子数之和等于
层电子数之和等于 、
、 层电子数之和;
层电子数之和; 元素是第三周期中第一电离能最小的元素;
元素是第三周期中第一电离能最小的元素; 元素在第三周期中第一电离能最大。下列有关叙述错误的是
元素在第三周期中第一电离能最大。下列有关叙述错误的是A. 、 、 、 、 、 、 分别为 分别为 、 、 、 、 、 、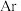 |
B.元素 、 、 、 、 两两组成的化合物可为 两两组成的化合物可为 、 、 、 、 、 、 等 等 |
C.元素 、 、 简单离子的半径大小关系为 简单离子的半径大小关系为 |
D.单质 、 、 还原性强弱关系为 还原性强弱关系为 |
您最近一年使用:0次
6 . 过渡金属单质及化合物具有广泛用途.回答下列问题:
(1)Co基态原子的核外电子排布式为_______ 。
(2)基态铜原子核外电子占据能级数为_______ ;核外电子共有_______ 种不同的运动状态。
(3)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是_______ 。
②与SCN-互为等电子体的非极性分子的化学式为_______ (任写一种)。
(4)化学上可用EDTA测定Fe2+和Co2+的含量EDTA的结构简式如图所示:

EDTA分子中,碳原子的杂化方式为_______ ,其分子中含有的四种非金属元素的电负性由大到小顺序为_______ 。
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,1mol Ni(CO)4分子中含有σ键数目为_______ . Ni(CO)4的中心原子价电子数与配位体提供电子总数之和为_______ 。
(6)Cr(CO)6是一种典型的羰基配合物.其配体为CO,则Cr(CO)6分子中π键的数目为_______ .已知形成Cr(CO)6时,Cr原子的杂化方式为d2sp3,根据原子轨道杂化规律,其杂化后形成的杂化轨道数为_______ 个,Cr(CO)6的分子立体构型为_______ 。
(7)硫酸锌溶于氨水可形成[Zn(NH3)4]2+离子,[Zn(NH3)4]2+离子具有对称的空间构型,其中两个NH3被两个Cl取代,只有一种产物,则[Zn(NH3)4]2+的空间构型为_______ 。
(8)元素铜的第一电离能ICu,元素锌的第一电离能IZn,已知ICu<IZn,其原因是_______ 。
(1)Co基态原子的核外电子排布式为
(2)基态铜原子核外电子占据能级数为
(3)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。
①与N同周期的主族元素中,第一电离能比N大的元素是
②与SCN-互为等电子体的非极性分子的化学式为
(4)化学上可用EDTA测定Fe2+和Co2+的含量EDTA的结构简式如图所示:

EDTA分子中,碳原子的杂化方式为
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,1mol Ni(CO)4分子中含有σ键数目为
(6)Cr(CO)6是一种典型的羰基配合物.其配体为CO,则Cr(CO)6分子中π键的数目为
(7)硫酸锌溶于氨水可形成[Zn(NH3)4]2+离子,[Zn(NH3)4]2+离子具有对称的空间构型,其中两个NH3被两个Cl取代,只有一种产物,则[Zn(NH3)4]2+的空间构型为
(8)元素铜的第一电离能ICu,元素锌的第一电离能IZn,已知ICu<IZn,其原因是
您最近一年使用:0次
7 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳(C)原子的核外电子排布图为___________ 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为___________ 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为_____ 。
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是_____ 。

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:___________ 。晶体中每个镁原子周围距离最近的镍原子有___________ 个。

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
①在周期表中,最可能处于同一族的是___________ 和___________ 。
②T元素最可能是___________ 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为___________ ,其中心原子的杂化方式为___________ 。
(1)基态碳(C)原子的核外电子排布图为
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子外围电子排布式为
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A~D图中正确的是

(5)据报道,只含镁、镍和碳三种元素的晶体具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的晶胞结构如图所示,试写出该晶体的化学式:

(6)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下列问题。
元素代号 | I1 | I2 | I3 | I4 |
Q | 2 080 | 4 000 | 6 100 | 9 400 |
R | 500 | 4 600 | 6 900 | 9 500 |
S | 740 | 1 500 | 7 700 | 10 500 |
T | 580 | 1 800 | 2 700 | 11 600 |
U | 420 | 3 100 | 4 400 | 5 900 |
①在周期表中,最可能处于同一族的是
②T元素最可能是
您最近一年使用:0次
2020-12-11更新
|
943次组卷
|
5卷引用:模块同步卷09 金属晶体与离子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)
(已下线)模块同步卷09 金属晶体与离子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)第37讲 晶体结构与性质(精练)-2021年高考化学一轮复习讲练测宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题山东省青岛市第二中学2022-2023学年高二上学期期末考试化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题
8 . A、B、C、D四种短周期元素,原子序数依次增大,已知A是地壳中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738kJ/mol、1451kJ/mol、7733kJ/mol;D在同周期元素中(除稀有气体元素外)第一电离能最大。
(1)试推断该四种元素并写出元素符号:A______ ;B______ ;C______ ;D______ 。
(2)C的第三电离能远大于其第二电离能的原因是______ 。
(3)写出电解熔融 的化学方程式:
的化学方程式:______ 。
(1)试推断该四种元素并写出元素符号:A
(2)C的第三电离能远大于其第二电离能的原因是
(3)写出电解熔融
 的化学方程式:
的化学方程式:
您最近一年使用:0次
2021-02-16更新
|
320次组卷
|
2卷引用:(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质
解题方法
9 . A、B、C、D是原子序数依次增大的四种短周期元素。已知A是地壳中含量最多的元素;B、C、D同周期,且B是同周期元素中第一电离能最小的元素;C的价电子排布式为 ;D是同周期元素(稀有气体元素除外)中第一电离能最大的元素。
;D是同周期元素(稀有气体元素除外)中第一电离能最大的元素。
(1)试推断这四种元素并写出其元素符号
A_______ ;B_______ ;C_______ ;D_______ 。
(2)写出A、B、C三种元素两两组成的3种化合物的化学式:_______ 。
(3)写出电解CD2的化学方程式:_______ 。
 ;D是同周期元素(稀有气体元素除外)中第一电离能最大的元素。
;D是同周期元素(稀有气体元素除外)中第一电离能最大的元素。(1)试推断这四种元素并写出其元素符号
A
(2)写出A、B、C三种元素两两组成的3种化合物的化学式:
(3)写出电解CD2的化学方程式:
您最近一年使用:0次
解题方法
10 . 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数的大小顺序为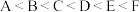 。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为______ 。
(2)B的氯化物的熔点比D的氯化物的熔点______ (填“高”或“低”),理由是______ 。
(3)A的简单氢化物分子的中心原子采取______ 杂化,E的低价氧化物分子的空间结构是______ 。
(4)基态F原子的核外电子排布式是______ ,F的高价离子与A的简单氢化物形成的配离子的化学式为______ ,其结构式是______ 。
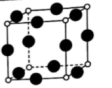
(5)A、F形成的某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为______ (每个球均表示1个原子)。
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______ ,其晶体中所含的化学键类型为______ 。
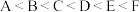 。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比D的氯化物的熔点
(3)A的简单氢化物分子的中心原子采取
(4)基态F原子的核外电子排布式是
(5)A、F形成的某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为

(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为
您最近一年使用:0次
2021-02-15更新
|
316次组卷
|
2卷引用:(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 章末综合检测卷



