解题方法
1 . 短周期主族元素 W 、X 、Y 、Z 的原子序数依次增大,W 、X 原子的最外层电子数之比为 4 ∶3 ,Y 原子 p 能级上有 2 个未成对电子,Z 原子比 X 原子的核外电子数多 4 。下列说法正确的是
| A.X 、Y 、Z 的电负性大小顺序是X>Y>Z |
| B.WY2 分子构型为 V 形 |
| C.W 、X 、Y 、Z 的原子半径大小顺序是X>Y>Z>W |
| D.W 、Z 形成的分子的空间构型是正四面体形 |
您最近一年使用:0次
2022-11-02更新
|
223次组卷
|
2卷引用:河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题
名校
2 . 自然界中硫的分布很广,存在形式有硫化物、硫酸盐和单质硫。请回答下列问题:
(1)硫元素位于元素周期表中的_______ 区。基态硫原子核外有_______ 种空间运动状态不同的电子,未成对的电子数为_______ 。
(2)三氧化硫是常见的硫的氧化物,液态三氧化硫有单分子[SO3]和三聚体([SO3)3]两种形式;固态三氧化硫主要以三聚体[(SO3)3]和无限长链[(SO3)n]两种形式存在。
①单分子[SO3]的空间构型为_______ 。
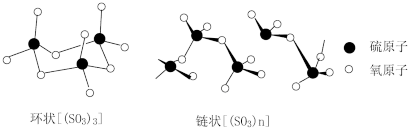
②环状[(SO3)3]和链状[(SO3)n]的结构如图所示。环状[(SO3)3]中硫原子的杂化轨道类型为_______ ,链状[(SO3)n]中发生杂化的氧原子有_______ (用含“n”的式子表示)个。
③常温下,单分子[SO3]是液体,而链状[(SO3)n]是固体的原因是_______ 。
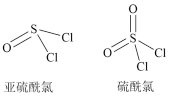
(3)硫的含氧衔生物——酰氯中亚硫酰氯和硫酰氯的结构如图所示,其中各元素电负性的大小顺序是_______ (用元素符号表示),两者中硫氯键之间的键角亚硫酰氯_______ (填“大于”“小于”或“等于”)硫酰氯。
(4)单质硫能与可溶性的金属硫化物溶液反应生成多硫化物(M2Sx),且多硫化物溶液的颜色随x的增大,越来越深。实验室中Na2S溶液长期放置颜色越来越深的原因是_______ 。
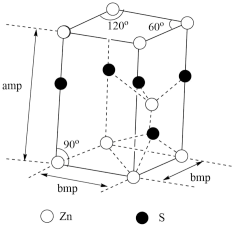
(5)含锌的某些硫化物具有独特的光电效应,广泛应用于荧光材料、电磁学等领域。某含锌硫化物的晶胞结构如图所示,该硫化物的化学式为_______ ,晶体中硫原子填充在锌原子构成的_______ 空隙中;若用NA表示阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含a、b、NA的式子表示)。
(1)硫元素位于元素周期表中的
(2)三氧化硫是常见的硫的氧化物,液态三氧化硫有单分子[SO3]和三聚体([SO3)3]两种形式;固态三氧化硫主要以三聚体[(SO3)3]和无限长链[(SO3)n]两种形式存在。
①单分子[SO3]的空间构型为
②环状[(SO3)3]和链状[(SO3)n]的结构如图所示。环状[(SO3)3]中硫原子的杂化轨道类型为
③常温下,单分子[SO3]是液体,而链状[(SO3)n]是固体的原因是

(3)硫的含氧衔生物——酰氯中亚硫酰氯和硫酰氯的结构如图所示,其中各元素电负性的大小顺序是

(4)单质硫能与可溶性的金属硫化物溶液反应生成多硫化物(M2Sx),且多硫化物溶液的颜色随x的增大,越来越深。实验室中Na2S溶液长期放置颜色越来越深的原因是
(5)含锌的某些硫化物具有独特的光电效应,广泛应用于荧光材料、电磁学等领域。某含锌硫化物的晶胞结构如图所示,该硫化物的化学式为

您最近一年使用:0次
2022-01-05更新
|
208次组卷
|
2卷引用:河北省神州智达省级联测2021-2022学年高三上学期第五次考试化学试题
名校
解题方法
3 . 由短周期元素组成的一种药物的分子结构式如图所示。其中,X原子的核外电子只有一种运动状态;元素Y、Z、W、E原子序数依次增大,基态W与E价电子排布均为ns2np5。下列说法不正确的是
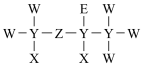
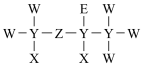
| A.元素电负性大小:X<Y<W |
| B.沸点高低:X2Z<X2Z2 |
| C.最简单气态氢化物分子的键长大小:E<W<Y |
| D.第一电离能大小:Y<Z<W |
您最近一年使用:0次
名校
4 . 下列各组元素中,电负性依次减小的是
| A.F、N、O | B.Cl、C、F | C.As、N、H | D.Cl、S、As |
您最近一年使用:0次
2022-01-21更新
|
374次组卷
|
6卷引用:河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题
名校
解题方法
5 . 短周期元素W、X、Y、Z的原子序数依次增大,它们组成一种团簇分子,结构如图所示。W、Z的族序数均等于周期序数,X原子核外最外层电子数是其电子总数的 ,下列说法正确的是
,下列说法正确的是
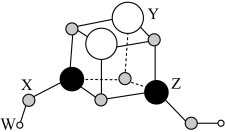
 ,下列说法正确的是
,下列说法正确的是
| A.电负性:X<Y<Z |
| B.常温下,W与X形成的化合物呈液态 |
| C.该团簇分子中原子均满足8电子稳定结构 |
| D.最高价氧化物的水化物的碱性:Y<Z |
您最近一年使用:0次
2023-08-14更新
|
251次组卷
|
2卷引用:河北省部分学校2023届高三4月大联考二模化学试题
名校
解题方法
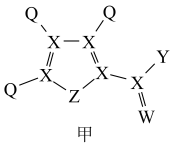
6 . 物质甲可作催化剂和阻燃剂,其结构如图所示,W、X、Y、Z为原子序数依次增大的短周期主族元素,基态X原子的s电子比p电子多3,Z是周期表中电负性最大的元素,W与Y可以形成一种极易溶于水的气体。下列说法正确的是
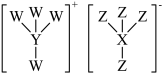
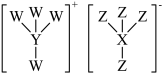
A.电负性: |
| B.物质甲含有离子键、极性共价键和非极性共价键 |
C.第一电离能: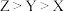 |
D.最简单氢化物的稳定性: |
您最近一年使用:0次
2023-04-30更新
|
251次组卷
|
3卷引用:河北昌秦皇岛市昌黎第一中学2023-2024学年高二上学期第五次调研考试化学试题
解题方法
7 . 我国科学家发现AgCrS2 (AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有___________ 个电子顺时针旋转。基态铬原子有___________ 个未成对电子。
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是___________ (填元素符号)。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。 的空间构型为
的空间构型为___________ ,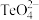 中碲的杂化类型是
中碲的杂化类型是___________ 。
③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(3)配合物 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ 。(Cr与O、N均形成了配位键)
(4)在银氨溶液中,1 mol 中含
中含___________ molσ键。
(5)复合材料氧铬酸钙的立方晶胞如图所示。
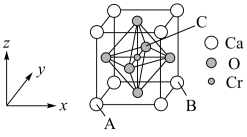
①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为___________ 。
②1个钙原子与___________ 个氧原子等距离且最近。
③该晶体密度为___________  (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。
 的空间构型为
的空间构型为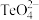 中碲的杂化类型是
中碲的杂化类型是③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(3)配合物
 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为(4)在银氨溶液中,1 mol
 中含
中含(5)复合材料氧铬酸钙的立方晶胞如图所示。

①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为
②1个钙原子与
③该晶体密度为
 (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
您最近一年使用:0次
2021-12-03更新
|
559次组卷
|
3卷引用:河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题
河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题河南省新乡市2021-2022学年高三上学期第一次模拟考试理综化学试题 (已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
8 . 化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、X、W、Z、Y为原子序数依次递增的短周期主族元素,Q、X、Z分别位于三个不同周期。下列说法错误的是

| A.简单离子半径:W<Y<Z | B.元素电负性:Q<Z<W |
| C.元素最高价氧化物对应水化物的酸性:Y>Z | D.化合物甲中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
9 . 第四周期的元素形成的化合物在生产生活中有着重要的用途。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为___________ ,按照电子排布式,镍元素在周期表中位于___________ 区。
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为___________ 形。砷的电负性比镓___________ (填“大”或“小”)。
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为___________ 。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为
您最近一年使用:0次
2023-11-01更新
|
143次组卷
|
2卷引用:河北省衡水市安平中学2023-2024学年高二下学期开学考试化学试题
解题方法
10 . M(结构如图)常用作农药中间体、橡胶助剂、合成树脂添加剂以及分析试剂等。X、Y、Z、W为短周期原子序数依次增大的主族元素,其中基态X原子内的电子只有1个运动状态,Y、Z位于X的下一周期,基态W原子s和p能级电子数之比为3:5。下列说法正确的是

| A.元素电负性:W>Z>Y | B.元素第一电离能:Y>Z>W |
| C.M分子中Y原子的孤电子对数为0 | D.M分子中σ键和π键数目之比为4:1 |
您最近一年使用:0次
2024-03-23更新
|
145次组卷
|
2卷引用:河北省邢台市名校质检联盟2023-2024学年高二上学期12月月考化学试题



