1 . I.表中列出了第三周期的几种元素的部分性质:
请按要求回答下列问题:
(1)写出基态a原子的价层电子排布式:____ 。
(2)表中元素原子半径最大的是(写元素符号)_____ 。
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)_____ 。
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为_____ 。
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)____ 。
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为____ 。
(7)下列说法合理的是____ 。
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出基态a原子的价层电子排布式:
(2)表中元素原子半径最大的是(写元素符号)
(3)a、b、c三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为
(5)表中五种元素的第一电离能由大到小的顺序是(写元素符号)
II.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(6)Se原子结构示意图可表示为
(7)下列说法合理的是
a.SeO2既有氧化性又有还原性 b.沸点:H2O<H2S<H2Se
c.热稳定性:H2Se<HCl<H2S d.酸性:H2SeO4<HBrO4<HClO4
您最近一年使用:0次
名校
解题方法
2 . 工业制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是_____ ,第二周期原子半径由大到小的是______ 。
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是______ ,该分子为_____ ( 选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式_____ ,下列关于该元素和氧元素之间非金属性大小判断依据正确的是____ (填编号)
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围______ 个NH3通过氢键相结合。
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是_____________ 。
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是
(3)写出上述元素中有三个未成对电子的原子核外电子排布式
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是
您最近一年使用:0次
真题
名校
3 . 日光灯中用到的某种荧光粉的主要成分为3W3(ZX4)2·WY2。已知:X、Y、Z和W为原子序数依次增大的前20号元素,W为金属元素。基态X原子s轨道上的电子数和p轨道上的电子数相等,基态X、Y、Z原子的未成对电子数之比为2:1:3。下列说法正确的是
| A.电负性:X>Y>Z>W |
| B.原子半径:X<Y<Z<W |
| C.Y和W的单质都能与水反应生成气体 |
| D.Z元素最高价氧化物对应的水化物具有强氧化性 |
您最近一年使用:0次
2023-06-16更新
|
10998次组卷
|
25卷引用:天津市耀华中学2023-2024学年高三上学期第一次月考化学试题
天津市耀华中学2023-2024学年高三上学期第一次月考化学试题2023年高考湖南卷化学真题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第19讲元素周期律与元素周期表安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)湖北省武汉市第六中学2023-2024学年高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)福建省厦门第一中学2024届高三上学期10 月月考化学试题河北省迁安市2023-2024学年高三上学期期中考试化学试题福州市福州高级中学2023-2024学年高三上学期10月月考化学试题福建省厦门第一中学2024届高三上学期第一次月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市第二十中学2023-2024学年高三上学期10月月考化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)福建省福州高级中学2023-2024学年高三上学期第一阶段考试化学试卷山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题(已下线)FHgkyldyjhx12
解题方法
4 . 回答下列问题:
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是____ ,氮元素原子核外有____ 个未成对电子,最外层有____ 种能量不同的电子。

(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是____ (填编号)。
a.NH3比PH3稳定性强 b.电负性数据:N3.0、P2.1
c.硝酸显强氧化性,磷酸不显强氧化性 d.氮气常温是气体,磷单质是固体
(3)2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
①要证明月壤中含有这些元素,可采用的方法是____ 。
②写出铜的基态原子的电子排布式____ 。
③周期表中,与铜位于同一周期的元素原子中最外层电子数与铜原子的相同的元素有____ (填元素符号)。
(1)如图所示为元素周期表中氮元素部分信息,数据“14.01”表示的是

(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是
a.NH3比PH3稳定性强 b.电负性数据:N3.0、P2.1
c.硝酸显强氧化性,磷酸不显强氧化性 d.氮气常温是气体,磷单质是固体
(3)2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
①要证明月壤中含有这些元素,可采用的方法是
②写出铜的基态原子的电子排布式
③周期表中,与铜位于同一周期的元素原子中最外层电子数与铜原子的相同的元素有
您最近一年使用:0次
解题方法
5 . ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)S单质的常见形式为 ,其环状结构如图所示,S原子的杂化轨道类型是
,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
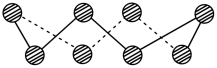
(3)基态Se原子的核外电子排布式为_______ 。
(4)S、Se、Te三种元素电负性由大到小的顺序是_______ ,三种元素氢化物水溶液的酸性最强的是_______ (填化学式)。
(5) 分子中共价键的类型是
分子中共价键的类型是_______ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是_______ 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为a pm,密度为_______  (NA表示阿伏加德罗常数的值)。
(NA表示阿伏加德罗常数的值)。

(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为
 ,其环状结构如图所示,S原子的杂化轨道类型是
,其环状结构如图所示,S原子的杂化轨道类型是
(3)基态Se原子的核外电子排布式为
(4)S、Se、Te三种元素电负性由大到小的顺序是
(5)
 分子中共价键的类型是
分子中共价键的类型是 是气体而
是气体而 是液体的原因是
是液体的原因是(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有
 (NA表示阿伏加德罗常数的值)。
(NA表示阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
6 . Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________ 。
(2)根据元素周期律,下列说法正确的是__________________ 。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______ 。
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:

若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________ (写元素名称),它在周期表中的位置为______ 。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________ 。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______ 。
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______ 。

(7)某铁的化合物结构简式如图所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为______ 。
(1)砷与磷为同一主族元素,砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:

若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为

(7)某铁的化合物结构简式如图所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
您最近一年使用:0次



