(1)E元素在周期表中的位置为
(2)B、C、D三种元素的第一电离能最大的是
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物CA5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
| 元素符号 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 |
| 元素符号 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)推测在同周期的元素中x值与原子半径的关系是
(2)通过分析x值的变化规律,确定Mg、N的x值范围:
(3)在P—N键中,共用电子对偏向
(4)经验规律告诉我们:当成键的两原子相应元素的x差值即Δx>1.7时,一般为离子键;Δx<1.7,一般为共价键。试推断:AlBr3中化学键类型是
(5)推测元素周期表中,x值最大的元素是
(6)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| x值 | 1.0 | 1.5 | 3.0 | 3.5 | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(1)试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为
(2)已知:Cl—Br+H
 H—Cl+HO—Br。
H—Cl+HO—Br。①若NCl3最初水解产物是NH3和HClO,则x(Cl)的最小范围是
②PCl3水解的化学反应方程式是
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,BeCl2属于
元素 |
|
|
|
|
|
|
|
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 |
|
|
|
|
|
|
|
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键原子元素间电负性差值大于1.7时,形成离子键,两成键原子元素间电负性差值小于1.7时,形成共价键.
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是
(2)通过分析电负性数值的变化规律,确定
 元素电负性数值的最小范围:
元素电负性数值的最小范围:(3)判断下列物质是离子化合物还是共价化合物:
A.
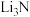 B.
B. C.
C. D.
D.
属于离子化合物的是
5 . 根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
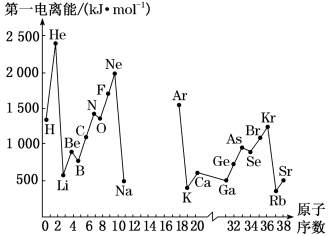
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
| A.电负性 | B.电离能 |
| C.非金属性 | D.电子绕核运动 |
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为
(5)B2A4是重要的石油化工原料,B2A4的结构式为
A.在第ⅥA族元素的氢化物( )中,热稳定性最强的其沸点也一定最高 )中,热稳定性最强的其沸点也一定最高 |
| B.第三周期元素的电负性一定小于第二周期元素的 |
| C.第二周期元素的最高正化合价都等于其原子的最外层电子数 |
| D.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 |
A.电负性: | B.离子半径: |
C.简单氢化物的稳定性: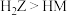 | D.第一电离能: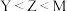 |
A. 中的 中的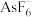 离子的空间结构为正八面体形 离子的空间结构为正八面体形 |
| B.C、H、O三种元素的电负性由小到大的顺序为H<C<O |
C.HClO、 、 、 的中心原子价层电子对数不完全相同 的中心原子价层电子对数不完全相同 |
| D.第四周期元素中,Ga的第一电离能低于Zn |
















