名校
解题方法
1 . 下表是某些短周期元素的电负性(x)值:
(1)根据上表试推测,元素周期表中除放射性元素外,电负性最小的元素与电负性最大的元素形成的化合物的电子式为___________ 。
(2)已知: 。
。
①若 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测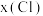 的范围是
的范围是___________ (填表中数值);
② 水解的化学反应方程式是
水解的化学反应方程式是___________ 。
(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析, 属于
属于___________ (填“离子化合物”或“共价化合物”),可设计实验证明,如测定___________ 。
| 元素符号 | Li | Be | N | O | F | Na | Mg | Al | P | S |
| x值 | 1.0 | 1.5 | 3.0 | a | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 |
(2)已知:
 。
。①若
 最初水解产物是
最初水解产物是 和HClO,根据
和HClO,根据 的化合价推测
的化合价推测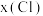 的范围是
的范围是②
 水解的化学反应方程式是
水解的化学反应方程式是(3)一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键,小于1.7通常形成共价键,结合问题(2)①进行分析,
 属于
属于
您最近一年使用:0次
2 . 元素周期表是学习、研究和应用化学的一种重要工具。如图为元素周期表前四周期的一部分,R、W、X、Y、Z代表五种元素,回答下列问题。
(1)基态R原子的电子排布式为______ 。
(2)W、X、Y三种元素的基态原子中,p能级未成对电子最多的是______ (填元素符号)。
(3)X、Z两种元素气态氢化物的稳定性:______ >______ (填化学式)。
(4)Y的第一电离能小于W的,结合价层电子排布式解释其原因_______ 。
(5)元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
已知:
i.通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M-O-H(M代表某种元素)结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH-或H+。
①通过分析电负性的变化规律,确定Mg元素电负性的最小范围______ 。
②下列物质属于离子化合物的是______ (填字母)。
a.BeCl2 b.Li3N c.HCl d.CCl4
③请设计实验方案证明②中你选出物质为离子化合物______ 。
④结合电负性数据,解释HClO水溶液显酸性而不显碱性的依据是______ 。
| X | |||
| W | Y | R | |
| Z |
(2)W、X、Y三种元素的基态原子中,p能级未成对电子最多的是
(3)X、Z两种元素气态氢化物的稳定性:
(4)Y的第一电离能小于W的,结合价层电子排布式解释其原因
(5)元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
| 元素 | Al | Be | Mg | C | Cl | Na | Li | N | Si | O | H |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
i.通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M-O-H(M代表某种元素)结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH-或H+。
①通过分析电负性的变化规律,确定Mg元素电负性的最小范围
②下列物质属于离子化合物的是
a.BeCl2 b.Li3N c.HCl d.CCl4
③请设计实验方案证明②中你选出物质为离子化合物
④结合电负性数据,解释HClO水溶液显酸性而不显碱性的依据是
您最近一年使用:0次
名校
解题方法
3 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子; 离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为___________ 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为___________ (填元素符号),其原因是___________ 。
(3)D元素与氟元素相比,电负性:D___________ (填“>”“=”或“<”)F,下列表述中能证明这一事实的是___________ (填选项序号)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)由AC两元素可形成化合物 含有的化学键类型为
含有的化学键类型为___________ 。
(5)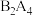 是重要的石油化工原料,
是重要的石油化工原料,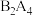 的结构式为
的结构式为___________ 。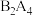 通过聚合反应可以生成一种有机高分子化合物,反应方程式为
通过聚合反应可以生成一种有机高分子化合物,反应方程式为___________ 。
(6) 分子的电子式为
分子的电子式为___________ ,在酸性溶液中 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
 离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)由AC两元素可形成化合物
 含有的化学键类型为
含有的化学键类型为(5)
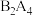 是重要的石油化工原料,
是重要的石油化工原料,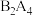 的结构式为
的结构式为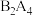 通过聚合反应可以生成一种有机高分子化合物,反应方程式为
通过聚合反应可以生成一种有机高分子化合物,反应方程式为(6)
 分子的电子式为
分子的电子式为 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)要证明月壤中含有这些元素,可采用的方法是___________ 。
(2)写出铜的基态原子的电子排布式:___________ 。
(3)月球表面的月海玄武岩中富含钛和铁,将月海玄武岩用硝酸溶解,所得溶液用 检验,溶液呈红色。
检验,溶液呈红色。 中K、C、N的电负性从大到小的顺序是
中K、C、N的电负性从大到小的顺序是___________ ,C原子的杂化轨道类型是___________ , 的空间构型是
的空间构型是___________ 形,1
 中含有的
中含有的 键数目是
键数目是___________ 。
(4)嫦娥五号采样机中的钻杆是由中国科学院科学家研制的碳化硅增强铝基复合材料制成,具有轻质、高刚度、高强度和耐磨损等特点。
①铝基复合材料中有一种重要的物质氮化铝( ,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于
,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于___________ (填晶体类型)。氮化铝可用氧化铝(熔点为2054℃)为原料来制取,从晶体类型角度分析 的熔点比氧化铝高的原因是
的熔点比氧化铝高的原因是___________ 。
②氮化铝的晶体结构如图所示,其中铝原子的配位数是___________ , 与N原子最近的距离为a
与N原子最近的距离为a ,则该晶体的密度为
,则该晶体的密度为___________  。(
。( 为阿伏加德罗常数的值,列出表达式即可)
为阿伏加德罗常数的值,列出表达式即可)

(1)要证明月壤中含有这些元素,可采用的方法是
(2)写出铜的基态原子的电子排布式:
(3)月球表面的月海玄武岩中富含钛和铁,将月海玄武岩用硝酸溶解,所得溶液用
 检验,溶液呈红色。
检验,溶液呈红色。 中K、C、N的电负性从大到小的顺序是
中K、C、N的电负性从大到小的顺序是 的空间构型是
的空间构型是
 中含有的
中含有的 键数目是
键数目是(4)嫦娥五号采样机中的钻杆是由中国科学院科学家研制的碳化硅增强铝基复合材料制成,具有轻质、高刚度、高强度和耐磨损等特点。
①铝基复合材料中有一种重要的物质氮化铝(
 ,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于
,熔点为2249℃),氮化铝属类金刚石氮化物,则它属于 的熔点比氧化铝高的原因是
的熔点比氧化铝高的原因是②氮化铝的晶体结构如图所示,其中铝原子的配位数是
 与N原子最近的距离为a
与N原子最近的距离为a ,则该晶体的密度为
,则该晶体的密度为 。(
。( 为阿伏加德罗常数的值,列出表达式即可)
为阿伏加德罗常数的值,列出表达式即可)
您最近一年使用:0次
名校
解题方法
5 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为_______ 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_______ (填元素符号)。B、C、D元素可以组合成平面三角形结构的微粒是_______ (填化学式)。
(3)D元素与氟元素相比,电负性:D_______ (填“>”“=”或“<”)F,下列表述中能证明这一事实的是_______ (填字母)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)E的晶胞如图所示,E原子的配位数为_______ 。

(5) 是重要的石油化工原料,
是重要的石油化工原料, 分子内
分子内 键与
键与 键的数目比
键的数目比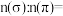
_______ 。
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)E的晶胞如图所示,E原子的配位数为

(5)
 是重要的石油化工原料,
是重要的石油化工原料, 分子内
分子内 键与
键与 键的数目比
键的数目比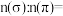
您最近一年使用:0次
名校
6 . 根据元素周期表和周期律相关知识,回答下列问题:
(1)C、N、O三种元素电负性由大到小排序_______ ,第一电离能由小到大排序_______ ;
(2)①O2-,②Al3+,③Cl-,④Ca2+的半径由大到小排列为:_______ (用序号表示);
(3)元素非金属性Cl_______ S(填“>”或“<”),请举例证明:_______ (可用方程式或客观事实回答);
(4)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:_______ 。
(1)C、N、O三种元素电负性由大到小排序
(2)①O2-,②Al3+,③Cl-,④Ca2+的半径由大到小排列为:
(3)元素非金属性Cl
(4)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置为_______ ,属于_______ 区。
(2)B、C、D三种元素的第一电离能最大的是_______ (填元素符号),第一电离能最大的原因是_______ 。
(3)D元素与氟元素相比,电负性:D_______ F(填“>”“=”或“<”),下列表述中能证明这一事实的是_______ (填字母)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物CA5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为_______ 。
(1)E元素在周期表中的位置为
(2)B、C、D三种元素的第一电离能最大的是
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物CA5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
您最近一年使用:0次
2022-08-28更新
|
312次组卷
|
4卷引用:新疆乌鲁木齐市第101中学2022-2023学年高二下学期4月期中化学试题
8 . 根据题给信息回答下列问题:
(1)某元素原子的价电子排布式为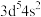 ,它属于第
,它属于第_______ 周期第_______ 族,属于_______ 区元素;第二周期的元素中第一电离能大于氧的元素有_______ 种。
(2)B、C、Al、Si四种原子中,第一电离能最大的是_______ ;价层电子排布式为 、
、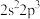 、
、 、
、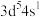 的四种元素中,电负性最大的是
的四种元素中,电负性最大的是_______ (填元素符号)。
(3)写出 的核外电子排布式:
的核外电子排布式:_______ 。
(4)某元素原子的3p轨道有1个未成对电子,该元素为_______ (填元素符号)。
(5)在短周期中能稳定存在且电负性相差最大的两种元素形成的化合物的电子式为_______ ;元素Y与元素Z相比,非金属性较强的是Z,下列表述中能证明这一事实的是_______ (填正确答案标号)。
A.常温下,Y的单质与Z的单质状态不同
B.等物质的量浓度的氢化物水溶液的酸性不同
C.Z的电负性大于Y
D.Z的简单氢化物比Y的简单氢化物稳定
E.在反应中,Y原子得电子数比Z原子得电子数多
(1)某元素原子的价电子排布式为
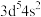 ,它属于第
,它属于第(2)B、C、Al、Si四种原子中,第一电离能最大的是
 、
、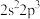 、
、 、
、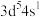 的四种元素中,电负性最大的是
的四种元素中,电负性最大的是(3)写出
 的核外电子排布式:
的核外电子排布式:(4)某元素原子的3p轨道有1个未成对电子,该元素为
(5)在短周期中能稳定存在且电负性相差最大的两种元素形成的化合物的电子式为
A.常温下,Y的单质与Z的单质状态不同
B.等物质的量浓度的氢化物水溶液的酸性不同
C.Z的电负性大于Y
D.Z的简单氢化物比Y的简单氢化物稳定
E.在反应中,Y原子得电子数比Z原子得电子数多
您最近一年使用:0次
解题方法
9 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置_____ ,属于_____ 区。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为___ (填元素符号),第一电离能最大的原因是____ 。
(3)D元素与氟元素相比,电负性:D____ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是____ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为___ ,它的晶体中含有多种化学键,但一定不含有的化学键是____ (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键____ mol。
(1)E元素在周期表中的位置
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键
您最近一年使用:0次
2021-04-21更新
|
203次组卷
|
3卷引用:河北省河间市第十四中学2020-2021学年高二下学期期中考试化学试题
10 . 钒(V)固氮酶种类众多,其中种结构如图所示:

(1)基态钒原子的核外电子排布式为________ ,该元素位于元素周期表的第___ 族。
(2)钒固氮酶中钒的配位原子有___ (写元素符号)。
(3)配体CH3CN中碳的杂化类型为____ 所含σ键与π键数目之比为___ 。
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为__________ (用元素符号表示)。
(5)写出证明非金属性Cl >S的一个常见离子方程式:__________ 。

(1)基态钒原子的核外电子排布式为
(2)钒固氮酶中钒的配位原子有
(3)配体CH3CN中碳的杂化类型为
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为
(5)写出证明非金属性Cl >S的一个常见离子方程式:
您最近一年使用:0次
2020-09-04更新
|
227次组卷
|
2卷引用:重庆市第八中学2018-2019学年高二下学期期中考试化学试题



