1 . 第四周期的元素形成的化合物在生产生活中有着重要的用途。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为___________ ,按照电子排布式,镍元素在周期表中位于___________ 区。
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为___________ 形。砷的电负性比镓___________ (填“大”或“小”)。
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为___________ 。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为
您最近一年使用:0次
2023-11-01更新
|
142次组卷
|
2卷引用:河北省衡水市安平中学2023-2024学年高二下学期开学考试化学试题
名校
2 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。
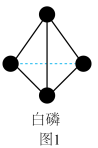
①白磷(P4)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③电负性:P___________ (填“>”“<”或“=”)O。
(2)磷,及其部分重要化合物的相互转化如图2所示。
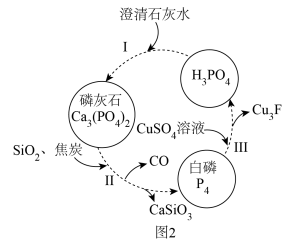
①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知:Cu3P不溶于水)。
(1)白磷(结构如图1所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(P4)的相对分子质量为
②基态P原子中成对电子数与未成对电子数之比为
③电负性:P
(2)磷,及其部分重要化合物的相互转化如图2所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③CO2和CO的组成元素相同,但二者的性质不完全相同,其原因为
④常温下,H3PO4与少量NaOH溶液反应的化学方程式为
(3)反应Ⅲ的离子方程式为
您最近一年使用:0次
2024-01-10更新
|
140次组卷
|
2卷引用:福建省泉州市永春第一中学2023-2024学年高二下学期开学化学试题
名校
3 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为_______ 。
② 元素在元素周期表中的位置是
元素在元素周期表中的位置是_______ 。
(2)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为_______ ,中心原子的杂化方式为_______ 。
(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:

①该钒的硫化物的化学式是_______ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是_______ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②
 元素在元素周期表中的位置是
元素在元素周期表中的位置是(2)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:

①该钒的硫化物的化学式是
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
您最近一年使用:0次
名校
4 . VA族元素及其化合物在生产、生活中用途广泛。
(1)① 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是______ 。
② 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为______ ,有______ 个未成对电子。
③P、S、 电负性由大到小的顺序是
电负性由大到小的顺序是______ 。
(2) 、
、 、
、 中沸点最高的是
中沸点最高的是______ ,其主要原因是______ 。
(3)白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为______ 。
(1)①
 常用于制造火柴,P和S的第一电离能较大的是
常用于制造火柴,P和S的第一电离能较大的是②
 俗称雄黄,其中基态
俗称雄黄,其中基态 原子的核外电子排布式为
原子的核外电子排布式为③P、S、
 电负性由大到小的顺序是
电负性由大到小的顺序是(2)
 、
、 、
、 中沸点最高的是
中沸点最高的是(3)白磷在氯气中燃烧可以得到
 和
和 ,其中气态
,其中气态 分子的立体构型为
分子的立体构型为
您最近一年使用:0次
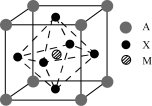
5 . I某钙钛矿型太阳能电池吸光材料的晶胞结构如图所示,其中A通常为CH3NH3+,可由甲胺(CH3NH2)制得;M为Pb2+或Sn2+;X为卤离子,如Cl-、Br-等。___ (用A、X、M表示)。
(2)H、C、Cl三种元素的电负性由小到大的顺序为____ 。
(3)溴原子基态核外价电子排布式为___ 。
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为___ 。
(5)CH3NH2中N原子的轨道杂化类型为__ ;1mol CH3NH3+中含σ键的数目为____ 。
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为___ 。
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是____ ;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为_____ 。
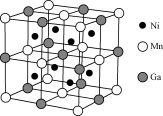
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为___ 。每个Mn周围最近且等距离的Mn数目为___ ,每个Ga周围最近且等距离的Mn数目为____ 。
(2)H、C、Cl三种元素的电负性由小到大的顺序为
(3)溴原子基态核外价电子排布式为
(4)甲胺(CH3NH2)极易溶于水,除因为它们都是极性分子外,还因为
(5)CH3NH2中N原子的轨道杂化类型为
II 镍的单质、合金及其化合物用途非常广泛。
(1)Ni在周期表中的位置为
(2)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4的熔沸点比C2H6高的多的原因是
(3)一种新型的功能材料的晶胞结构如图所示,它的化学式可表示为
您最近一年使用:0次
名校
解题方法
6 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________________________________ 。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子中含有的化学键是_________________ 。
a.配位键 b.离子键 c. 键 d.
键 d. 键
键
②乙二胺分子中氮原子的杂化轨道类型为________________________ ,C、N、H三种元素的电负性由大到小顺序是________________________________ 。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是_______________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是_____________________________ 。(请结合原子的性质进行回答)
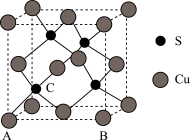
(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为____________________
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为____________________ 。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏伽德罗常数值为NA。列式表示该晶体中原子的空间利用率______________ 。
(1)铜元素基态原子的价电子排布式
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子中含有的化学键是
a.配位键 b.离子键 c.
 键 d.
键 d. 键
键②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是

(4)Cu和S形成某种晶体的晶胞如图所示。
①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏伽德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次



