1 . “嫦娥石”是中国首次在月球上发现的新矿物,其主要由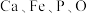 和
和 (钇,原子序数比
(钇,原子序数比 大13)组成,下列说法正确的是
大13)组成,下列说法正确的是
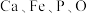 和
和 (钇,原子序数比
(钇,原子序数比 大13)组成,下列说法正确的是
大13)组成,下列说法正确的是| A.Y位于元素周期表的第ⅢB族 |
B.基态 原子的核外电子填充在6个轨道中 原子的核外电子填充在6个轨道中 |
C.5种元素中,第一电离能最小的是 |
D.5种元素中,电负性最大的是 |
您最近一年使用:0次
2023-09-28更新
|
4600次组卷
|
6卷引用:江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题
江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题2023年重庆市高考化学试卷(已下线)选择题6-10湖北省武汉市华中师范大学第一附属中学2023-2024学年高一下学期4月期中考试化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
名校
2 . 过渡元素镍(Ni)、铬(Cr)都是重要的合金元素,他们的配合物在科技生活中都有很重要的应用,例如我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:

回答下列问题:
(1)Cr3+价电子核外电子排布式为______ ,分子甲中除铬外其他元素的电负性由大到小依次为______ (填元素符号)。
(2)一定条件下环戊二烯 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为_____ , 中大π键可表示为
中大π键可表示为_____ 。
(3)化合物丙中1、2、3、4处的化学键是配位键的是_______ 。
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是__________ 。
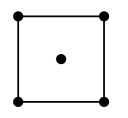
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为_________ 。
(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是_________ (用字母a、b、c表示),晶胞中镍的分数坐标有____ 种。


回答下列问题:
(1)Cr3+价电子核外电子排布式为
(2)一定条件下环戊二烯
 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为 中大π键可表示为
中大π键可表示为(3)化合物丙中1、2、3、4处的化学键是配位键的是
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为

(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是

您最近一年使用:0次
3 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。在上述反应中,非金属元素的电负性最大的是_______ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价电子轨道表示式为_______ 。
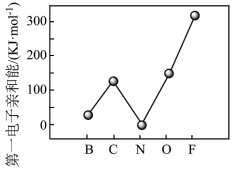
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的变化趋势E1如图所示。氮元素的(E1)呈现异常的原因是_______ 。
(3)已知As元素的相关信息如图所示,下列说法不正确的是_______ 。
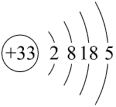
(4)相同条件下CO2与SO2分子在水中的溶解度较大的是_______ (写分子式),理由是_______ 。
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。在上述反应中,非金属元素的电负性最大的是
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价电子轨道表示式为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的变化趋势E1如图所示。氮元素的(E1)呈现异常的原因是

(3)已知As元素的相关信息如图所示,下列说法不正确的是
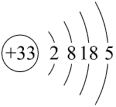
| A.推测As能形成多种氧化物 |
| B.热稳定性:AsH3、H2S、HCl逐渐增强 |
C.As的一种核素表示为 As中子数为40 As中子数为40 |
| D.原子半径由大到小的顺序:As、Cl、Si |
您最近一年使用:0次
名校
解题方法
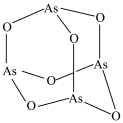
4 . 亚砷酸铵 ,易溶于水,可利用
,易溶于水,可利用 (分子结构如图)制备,该反应的化学方程式为
(分子结构如图)制备,该反应的化学方程式为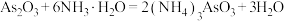 。下列说法错误的是
。下列说法错误的是
 ,易溶于水,可利用
,易溶于水,可利用 (分子结构如图)制备,该反应的化学方程式为
(分子结构如图)制备,该反应的化学方程式为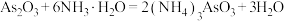 。下列说法错误的是
。下列说法错误的是
A. 的 的 的杂化形式为 的杂化形式为 杂化 杂化 |
B.砷的原子结构示意图为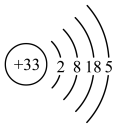 |
C.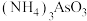 中阳离子的空间结构为正四面体形 中阳离子的空间结构为正四面体形 |
D.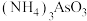 中元素的电负性由大到小的顺序为 中元素的电负性由大到小的顺序为 |
您最近一年使用:0次
2023-09-12更新
|
220次组卷
|
2卷引用:辽宁省沈阳市五校协作体2023-2024学年高二上学期期中考试化学试题
5 . 由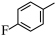 经两步反应合成
经两步反应合成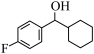 的步骤如下:
的步骤如下:
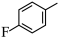
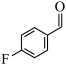
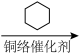
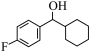
完成下列问题:
(1)上述有机物涉及的3种第二周期元素,其电负性由小到大排序依次是___________ 。
(2)用“*”标记出下图分子中的手性碳原子________ 。
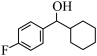
(3)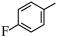 的分子式是
的分子式是___________ ,其中碳原子的杂化类型是___________ ,分子中有___________ 个原子参与形成离域键。
(4)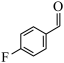 转化为
转化为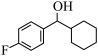 的过程中,C=O键中的
的过程中,C=O键中的___________ (填“σ”或“π”)键断裂,所属的有机反应基本类型是___________ 反应。
 经两步反应合成
经两步反应合成 的步骤如下:
的步骤如下:
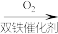



完成下列问题:
(1)上述有机物涉及的3种第二周期元素,其电负性由小到大排序依次是
(2)用“*”标记出下图分子中的手性碳原子

(3)
 的分子式是
的分子式是(4)
 转化为
转化为 的过程中,C=O键中的
的过程中,C=O键中的
您最近一年使用:0次
2023-09-10更新
|
256次组卷
|
2卷引用:吉林省长春外国语学校2023-2024学年高三上学期11月期中考试化学试题
名校
6 . 白铜是一种延展性好、硬度高、色泽美观、耐腐蚀的合金材料,其主要成分为Cu、Ni、Zn,还含有少量S、P、As等元素。关于上述涉及到的元素,下列说法正确的是
| A.原子半径:r(P)>r(As) | B.电负性:x(P)>x(S) |
| C.第一电离能:I1(S)<I1(P) | D.酸性:H3PO4<H3AsO4 |
您最近一年使用:0次
2023-09-08更新
|
149次组卷
|
3卷引用:江苏省盐城第一中学2023-2024学年高二上学期第二次学情调研考试(期中)化学(选修)试卷
7 . 软钾镁矾(化学式为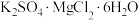 )是一种重要的钾肥。下列说法正确的是
)是一种重要的钾肥。下列说法正确的是
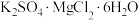 )是一种重要的钾肥。下列说法正确的是
)是一种重要的钾肥。下列说法正确的是A.电离能大小: | B.电负性大小: |
C.半径大小: | D.碱性强弱: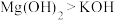 |
您最近一年使用:0次
2023-09-05更新
|
279次组卷
|
3卷引用:江苏省泰州中学2023-2024学年高二上学期期中考试化学试卷
8 . 短周期元素W、X、Y、Z的原子序数依次递增,W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。科学家将这四种元素的原子“组装”成一种超分子,具有高效的催化性能,其分子结构如图所示(实线代表共价键,其他重复单元的W、X未标注),下列说法错误的是
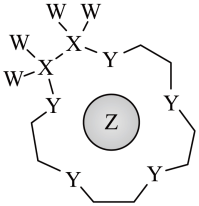

| A.电负性:Y>X | B.离子半径:Z>Y |
| C.W与X可组成多种共价化合物 | D.简单氢化物的键角:X>Y |
您最近一年使用:0次
2023-09-01更新
|
698次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高三上学期11月期中化学试题
黑龙江省哈尔滨师范大学附属中学2023-2024学年高三上学期11月期中化学试题辽宁省鞍山市2023-2024学年高三上学期第一次质量监测化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
9 . 冠醚(R,结构如下)是由多个二元醇分子之间失水形成的环状化合物。冠醚与 发生的反应为如下,下列说法正确的是
发生的反应为如下,下列说法正确的是
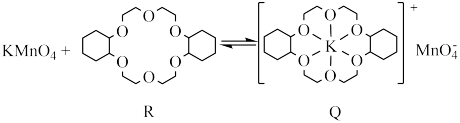
 发生的反应为如下,下列说法正确的是
发生的反应为如下,下列说法正确的是
| A.常温下,R易溶于水 |
B. 元素位于周期表中 元素位于周期表中 区 区 |
C.Q分子中,非金属元素之间的电负性: |
| D.R分子中所有的氧原子最外层均达到8电子稳定结构 |
您最近一年使用:0次
2023-08-20更新
|
176次组卷
|
3卷引用:山西省忻州一中忻州实验中学校2022-2023学年高二下学期4月期中联考化学试题
名校
10 . 现有四种元素的基态原子的电子排布式:①1s22s22p63s23p2 ②1s22s22p63s23p3③1s22s22p3 ④1s22s22p4。则下列有关比较正确的是
| A.原子半径:③>②>① | B.电负性:④>③>②>① |
| C.第一电离能:④>③>②>① | D.最高正化合价:④>③>②>① |
您最近一年使用:0次
2023-08-16更新
|
334次组卷
|
5卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题



