解题方法
1 . 合成氨N2+3H2 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
(1)基态N原子中,电子占据最高能级的符号是___________ ,占据该能级电子的电子云轮廓图为___________ 形。
(2)26号元素Fe基态原子的价层电子轨道表示式是___________ 。
(3)24Cr的价层电子排布式为___________ ,在元素周期表中位于___________ 区(填“s”“p”“d”或“ds”)。
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N___________ H(填“>”“<”或“=”)。
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式___________ 。
 2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:
2NH3是人类科学技术发展史上的一项重大成就。目前合成氨工业中使用的催化剂铁触媒中主要成分为Fe3O4(Fe2O3•FeO),还含有少量的K2O、Al2O3、MgO、CaO、Cr2O3等。回答问题:(1)基态N原子中,电子占据最高能级的符号是
(2)26号元素Fe基态原子的价层电子轨道表示式是
(3)24Cr的价层电子排布式为
(4)NH3分子中,与N原子相连的H显正电性。分析电负性大小关系为N
(5)工业上电解Al2O3制备铝,常用冰晶石Na3[AlF6]来降低Al2O3的熔点,请写出Na3[AlF6]电离方程式
您最近一年使用:0次
2 . 下列关于元素或物质性质的比较中,不正确 的是
A.稳定性: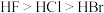 | B.第一电离能: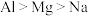 |
C.酸性: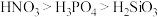 | D.电负性: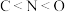 |
您最近一年使用:0次
3 . 完成下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________
(2)①基态Cu原子有___________ 种不同能级的电子。位于在周期表___________ 区(填s、p、d或ds)。Cu+的价电子排布式为___________ 。
②N原子中最高能级的电子的电子云轮廓图为___________ 。
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是___________ 。
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:___________ 。
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用___________ 盛装(填 酸式滴定管 或 碱式滴定管)滴定终点溶液的判断是___________ 颜色变化为由无色变为浅红色。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①基态Cu原子有
②N原子中最高能级的电子的电子云轮廓图为
③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
(3)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
(4)高锰酸钾是一种重要的化学试剂,实验室常常利用高锰酸钾溶液测定草酸晶体(H2C2O4·xH2O)中
 的值,高锰酸钾溶液需用
的值,高锰酸钾溶液需用
您最近一年使用:0次
解题方法
4 . 回答下列问题。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是___________ 。
(2)①O2-、②Al3+、③Cl-、④Ca2+的半径由大到小排列为:___________ (用序号表示)。
(3)下列属于氧原子激发态的轨道表示式的有___________ (填字母)。
a.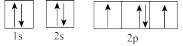 b.
b.
c.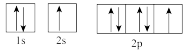 d.
d.
(4)Cu的价层电子排布式为___________ ,位于在周期表___________ 区(填s、p、d或ds)。
(5)基态Si原子中,电子占据的最高能层符号为___________ 。
(6)基态S原子的原子核外电子有___________ 种空间运动状态,其能量最高的电子电子云轮廓图为___________ 形。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①O2-、②Al3+、③Cl-、④Ca2+的半径由大到小排列为:
(3)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(4)Cu的价层电子排布式为
(5)基态Si原子中,电子占据的最高能层符号为
(6)基态S原子的原子核外电子有
您最近一年使用:0次
解题方法
5 . 铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
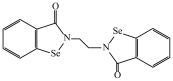
①已知Se与S在同一主族,基态Se原子的核外电子排布式为[Ar]_______ 。
②比较键角的大小:气态 分子
分子_______  离子(填“>”、“<”或“=”),原因是
离子(填“>”、“<”或“=”),原因是_______ 。
(2)富马酸亚铁(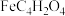 )是一种补铁剂。富马酸分子的结构模型如图所示:
)是一种补铁剂。富马酸分子的结构模型如图所示:
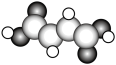
下列相关说法正确的是_______。
(3)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为_______ 。
②Fe原子的配位数为_______ 。
③该晶胞参数a=b=0.4nm,c=1.4nm。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①已知Se与S在同一主族,基态Se原子的核外电子排布式为[Ar]
②比较键角的大小:气态
 分子
分子 离子(填“>”、“<”或“=”),原因是
离子(填“>”、“<”或“=”),原因是(2)富马酸亚铁(
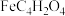 )是一种补铁剂。富马酸分子的结构模型如图所示:
)是一种补铁剂。富马酸分子的结构模型如图所示:
下列相关说法正确的是_______。
| A.富马酸分子中σ键和π键的数目比是10:3 |
B.富马酸分子中C的杂化方式有 、 、 |
| C.富马酸分子可以形成分子内氢键,使得富马酸一级和二级电离常数变大 |
| D.富马酸亚铁中各元素的电负性由大到小的顺序为O>C>H>Fe |
(3)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm,c=1.4nm。阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
6 . 深入研究物质的微观结构,有利于理解物质变化的本质。请回答下列问题:
(1)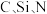 的电负性由大到小的顺序是
的电负性由大到小的顺序是___________ 。
(2)C、N、O、F的第一电离能由大到小的顺序是___________ 。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为 或
或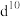 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,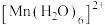
_________ 颜色(填“无”或“有”)。
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ (填元素符号)。
(5) 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 ,
,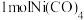 中含有
中含有__________  键。
键。
(1)
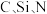 的电负性由大到小的顺序是
的电负性由大到小的顺序是(2)C、N、O、F的第一电离能由大到小的顺序是
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
 或
或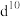 排布时,无颜色;为
排布时,无颜色;为 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,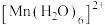
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是
(5)
 能与
能与 形成正四面体形的配合物
形成正四面体形的配合物 ,
,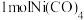 中含有
中含有 键。
键。
您最近一年使用:0次
7 . 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。回答下列问题。
(1)Fe 位于元素周期表中第_______ 周期第_______ 族,其价层电子排布式为_______ 。
(2)用“>”“<”或“=”填空:离子半径:Li+_______ H-;第一电离能:Li_______ Be;电负性:O_______ P。
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.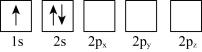 B.
B.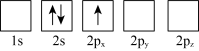
C. D.
D.
(4)基态 P 中未成对电子数为_______ ,其原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
(1)Fe 位于元素周期表中第
(2)用“>”“<”或“=”填空:离子半径:Li+
(3)下列 Li 原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(4)基态 P 中未成对电子数为
您最近一年使用:0次
解题方法
8 . 相同条件下,下列比较不正确的是
A.键角大小: | B.范德华力强弱: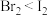 |
| C.水中溶解度:乙醇<戊醇 | D.酸性:氯乙酸<二氯乙酸 |
您最近一年使用:0次
9 . 以下有关元素性质的说法不正确的是
| A.具有下列电子排布式的原子:①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是④ |
| B.具有下列价电子排布式的原子:①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb ②N、P、S ③Na、P、Cl,元素的电负性随原子序数增大而增大的是③ |
| D.某主族元素气态基态离子的逐级电离能数据(单位:kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703……它与氯气反应时,生成的阳离子是X3+ |
您最近一年使用:0次
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的 能级上未成对电子数是同周期中最多的,Y元素基态原子中电子的运动状态有8种,Z元素的焰色试验为黄色,W元素的原子最外层电子排布式为
能级上未成对电子数是同周期中最多的,Y元素基态原子中电子的运动状态有8种,Z元素的焰色试验为黄色,W元素的原子最外层电子排布式为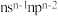 。下列说法正确的是
。下列说法正确的是
 能级上未成对电子数是同周期中最多的,Y元素基态原子中电子的运动状态有8种,Z元素的焰色试验为黄色,W元素的原子最外层电子排布式为
能级上未成对电子数是同周期中最多的,Y元素基态原子中电子的运动状态有8种,Z元素的焰色试验为黄色,W元素的原子最外层电子排布式为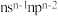 。下列说法正确的是
。下列说法正确的是A.原子半径: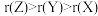 | B.电负性: |
C.最高价氧化物对应水化物的碱性: | D.第一电离能: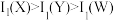 |
您最近一年使用:0次
2024-03-07更新
|
343次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题



