名校
1 . 回答下列问题:
(1)钒(23V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为___________ 。第四周期未成对电子数最多的元素是___________ (填元素符号),该元素基态原子核外电子共有___________ 种不同能量的电子。
(2)丁二酮(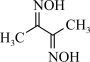 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为___________ ,该物质中,σ键与π键数目之比为___________ 。
(3)比较键角大小: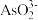
___________  (填>、<或=)。
(填>、<或=)。
(4)CH3CN中C原子的杂化类型为___________ 。
(5)铜的下列状态中,失去最外层一个电子所需能量最小的是___________。
(1)钒(23V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为
(2)丁二酮(
 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为(3)比较键角大小:
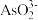
 (填>、<或=)。
(填>、<或=)。(4)CH3CN中C原子的杂化类型为
(5)铜的下列状态中,失去最外层一个电子所需能量最小的是___________。
| A.[Ar]3d104p1 | B.[Ar]3d10 | C.[Ar]3d94s1 | D.[Ar]3d104s1 |
您最近一年使用:0次
2024-02-10更新
|
634次组卷
|
3卷引用:吉林省长春市东北师大附属中学2023-2024学年高二上学期 期末化学试卷
名校
2 . 根据要求回答下列问题:
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是_________ 。
(2)①O2- ②Al3+ ③Cl- ④Ca2+的半径由大到小排列为:________ (用序号表示)。
(3)下列属于氧原子激发态的轨道表示式的有___________ (填字母)。_________ ,位于在周期表______ 区(填s、p、d或ds)。
(5)基态Si原子中,电子占据的最高能层符号为________ 。
(6)基态S原子的原子核外电子有______ 种空间运动状态,其能量最高的电子电子云轮廓图为______ 形。
(7)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:________ 。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①O2- ②Al3+ ③Cl- ④Ca2+的半径由大到小排列为:
(3)下列属于氧原子激发态的轨道表示式的有
a.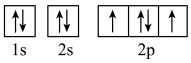 b.
b.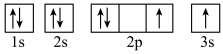
c.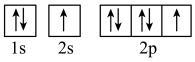 d.
d.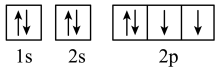
(5)基态Si原子中,电子占据的最高能层符号为
(6)基态S原子的原子核外电子有
(7)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
您最近一年使用:0次
2024-02-07更新
|
329次组卷
|
3卷引用:山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题
名校
3 . W、X、Y、Z、M是原子序数依次增大的5种短周期元素,其元素性质或原子结构如下:
请完成下列空白:
(1)W的元素符号为________ 。
(2)写出Y的价层电子排布式:_________ 。
(3)下列状态的X中,电离最外层一个电子所需能量最小的是______ (填序号)。
a.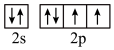 b.
b.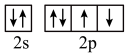 c.
c.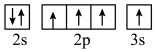
(4)基态M-占据的最高能级的电子云轮廓图的形状是_______ 。
(5)X、Z和M三种元素的电负性由大到小的顺序:_____ (请填元素符号)。
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:______ (请填元素符号)。
| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| M | 只有一个未成对电子 |
(1)W的元素符号为
(2)写出Y的价层电子排布式:
(3)下列状态的X中,电离最外层一个电子所需能量最小的是
a.
 b.
b. c.
c.
(4)基态M-占据的最高能级的电子云轮廓图的形状是
(5)X、Z和M三种元素的电负性由大到小的顺序:
(6)X与同周期相邻的其它两种元素,它们的第一电离能由大到小的顺序:
您最近一年使用:0次
2024-02-02更新
|
193次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试 化学试卷
名校
解题方法
4 . 下列关于物质结构或性质及解释都正确的是
| 物质结构或性质 | 解释 | |
| A | 键角: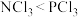 | N的电负性比P大,孤电子对对成键电子对的斥力比较大 |
| B | 稳定性:HF>HCl | HF分子间可以形成氢键,HCl没有氢键 |
| C | 配位键的稳定性: |  中O电负性更大,因而形成的配位键更稳定 中O电负性更大,因而形成的配位键更稳定 |
| D | 电子云半径:2s<4s | 4s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)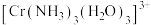 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
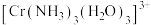 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近一年使用:0次
2024-02-01更新
|
277次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
6 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
I.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
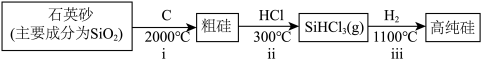
(1)下列事实能作为“非金属性C比Si强”的证据的是___________ (填字母)。
a.i中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ii中,lmolSi与3molHCl反应转移4mol电子。
①该反应的化学方程式为___________ 。
②SiHCl3中,H的化合价为___________ ,由此推测Si的电负性比H的___________ (填“大”或“小”)。
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:___________ 。
II.黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O。
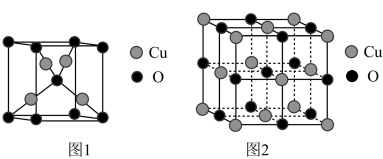
(4)下图中,表示Cu2O晶胞的是___________ (填“图1”或“图2”)。
(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是___________ 。
(6)CuFeS2的晶胞如图3所示。
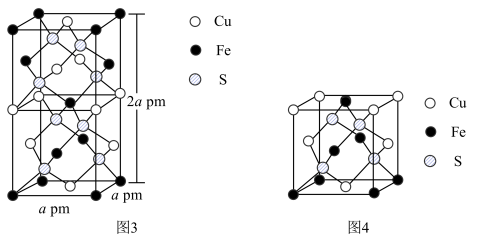
①图4所示结构单元不能作为CuFeS2晶胞的原因是___________ 。
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为___________ 。
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA.CuFeS2晶胞中底边边长___________ pm(用计算式表示;1cm=10-l0pm;CuFeS2的摩尔质量为184g/mol)。
I.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是
a.i中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ii中,lmolSi与3molHCl反应转移4mol电子。
①该反应的化学方程式为
②SiHCl3中,H的化合价为
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
II.黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O。
(4)下图中,表示Cu2O晶胞的是

(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是
(6)CuFeS2的晶胞如图3所示。

①图4所示结构单元不能作为CuFeS2晶胞的原因是
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA.CuFeS2晶胞中底边边长
您最近一年使用:0次
2024-01-31更新
|
328次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
7 .  、
、 、
、 、
、 、
、 是周期表中的短周期主族元素,原子序数依次增大。
是周期表中的短周期主族元素,原子序数依次增大。 在所有元素中原子半径最小,
在所有元素中原子半径最小, 、
、 基态原子核外均有2个未成对电子,
基态原子核外均有2个未成对电子, 基态原子具有6种不同空间运动状态的电子。下列说法正确的是
基态原子具有6种不同空间运动状态的电子。下列说法正确的是
 、
、 、
、 、
、 、
、 是周期表中的短周期主族元素,原子序数依次增大。
是周期表中的短周期主族元素,原子序数依次增大。 在所有元素中原子半径最小,
在所有元素中原子半径最小, 、
、 基态原子核外均有2个未成对电子,
基态原子核外均有2个未成对电子, 基态原子具有6种不同空间运动状态的电子。下列说法正确的是
基态原子具有6种不同空间运动状态的电子。下列说法正确的是A.简单离子半径: |
B.元素电负性: |
C. 最高价氧化物对应水化物的酸性: 最高价氧化物对应水化物的酸性: |
D. 和 和 可以形成含有非极性键的极性分子 可以形成含有非极性键的极性分子 |
您最近一年使用:0次
名校
8 . 短周期主族元素X、Y、Z、W的原子序数依次增大。基态Y原子最外层电子排布式为 ,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
 ,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是| A.简单离子半径:Z>W>Y | B.电负性:X>Y>W |
| C.ZXY含离子键和共价键 | D.工业上电解熔融 制备Z的单质 制备Z的单质 |
您最近一年使用:0次
名校
9 . 下列是某同学学习相关知识后总结的规律,其中错误的是
A.Zn、Fe、Cu单质活泼性依次减弱, 、 、 、 、 氧化性依次增强 氧化性依次增强 |
B.一定温度下,一元弱酸HA的 越小,则NaA的 越小,则NaA的 越大 越大 |
C.电解时, 、 、 、 、 放电能力依次减弱, 放电能力依次减弱, 、 、 、 、 氧化性依次增强 氧化性依次增强 |
| D.元素的电负性越大,该原子的第一电离能越大 |
您最近一年使用:0次
10 . EDTA是化学中一种良好的配合剂,常用于测定金属离子的含量。EDTA与Fe3+形成配合物的结构示意图如下,回答下列问题:
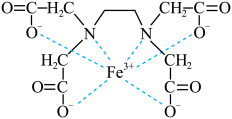
(1)基态N原子占据的最高能级 的符号是___________ ,电子云轮廓是___________ 形的。
(2)基态Fe3+的价层 电子排布式为___________ ,按照核外电子排布,把元素周期表划分为五个区,铁位于___________ 区。
(3)该物质中C、H、N、O的电负性由大到小的顺序是___________ 。
(4)比较N与O第一电离能的大小并从原子结构的角度分析___________ 。

(1)基态N原子占据的最高
(2)基态Fe3+的
(3)该物质中C、H、N、O的电负性由大到小的顺序是
(4)比较N与O第一电离能的大小并从原子结构的角度分析
您最近一年使用:0次



