名校
解题方法
1 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
342次组卷
|
9卷引用:天津市耀华中学2022-2023学年高二上学期期末考试化学试题
天津市耀华中学2022-2023学年高二上学期期末考试化学试题2.2.2元素第一电离能和电负性的周期性变化 课后陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区四川省西充中学 2021-2022 学年高二上学期期中考试化学试题专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
解题方法
2 . 酞菁钴被广泛应用于光电材料、光动力学光敏材料等方面。酞菁钴(II)结构如图所示(Co均形成单键,部分化学键未画明)。下列说法错误的是( )
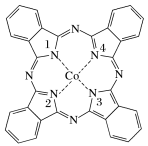

| A.酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H |
| B.酞菁钴(II)中碳原子的杂化方式只有sp2杂化 |
| C.1号和3号N原子的VSEPR模型均为平面三角形 |
| D.2号和4号N原子与Co(Ⅱ)是通过配位键结合 |
您最近一年使用:0次
2020-06-08更新
|
116次组卷
|
2卷引用:四川省自贡市2022-2023学年高二下学期期末考试化学试题
名校
3 . 下列说法正确的是( )
| A.原子半径:P<S<Cl |
| B.电负性:C<N<O |
| C.热稳定性:HF<HCl<HBr |
| D.第一电离能:Na<Mg<Al |
您最近一年使用:0次
2020-05-19更新
|
412次组卷
|
6卷引用:辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期末考试化学试题
名校
4 . 以下有关元素性质的说法不正确的是( )
| A.具有下列电子排布式的原子①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① |
| B.具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3④3s23p4第一电离能最大的是④ |
| C.①Na、K、Rb②N、P、As③O、S、Se④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
您最近一年使用:0次
2019-11-27更新
|
195次组卷
|
3卷引用:吉林省长春市东北师大附属中学2023-2024学年高二上学期 期末化学试卷
10-11高二下·内蒙古赤峰·期末
名校
解题方法
5 . 一个价电子构型为2s22p5的元素,下列有关它的描述正确的有
| A.原子序数为7 | B.周期表中第一电离能最小 |
| C.周期表中电负性最大 | D.周期表中原子半径最大 |
您最近一年使用:0次
名校
解题方法
6 . 元素化学性质随着原子序数的递增呈现周期性变化的原因是
| A.原子半径的周期性变化 |
| B.电负性的周期性变化 |
| C.第一电离能的周期性变化 |
| D.原子核外电子排布的周期性变化 |
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
3卷引用:吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题
名校
解题方法
7 . 图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
请回答下列问题:
(1)写出E元素的离子结构示意图______________________ ;
(2)X的值应为___________ (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系_______________ ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:__________ (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:_____________
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:_____________
| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
(2)X的值应为
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
513次组卷
|
5卷引用:天津市耀华中学2022-2023学年高一上学期期末考试化学试题
天津市耀华中学2022-2023学年高一上学期期末考试化学试题天津市耀华中学2022-2023学年高一上学期期末考试化学试题2014-2015河南省实验中学高一下学期期中考试化学试卷2016-2017学年山西省太原市外国语学校高一下学期第一次月考化学试卷(已下线)第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
14-15高二上·山西朔州·阶段练习
名校
8 . 下列各选项所述的两个量,前者一定大于后者的是
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径
| A.①⑤⑥⑦ | B.②③⑤ | C.②④⑦ | D.全对 |
您最近一年使用:0次
2016-12-09更新
|
1105次组卷
|
3卷引用:云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题
云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题(已下线)2013-2014学年山西省朔州市应县一中高二上学期第四次月考化学试卷广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题



