名校
解题方法
1 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近一年使用:0次
2023-07-29更新
|
112次组卷
|
6卷引用:云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题
云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1
名校
解题方法
2 . DDQ是一种常用的有机氧化剂,结构式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,W半径大于Z。下列说法正确的是
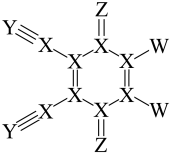
| A.简单离子半径:Z>Y | B.元素的电负性:Z>W |
| C.简单气态氢化物沸点:Y<X | D.含氧酸的酸性:W>X |
您最近一年使用:0次
2023-07-28更新
|
144次组卷
|
3卷引用:海南省海南中学2022-2023学年高二下学期期末考试化学试题
海南省海南中学2022-2023学年高二下学期期末考试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)宁夏银川市贺兰县第一中学2023-2024学年高二下学期第一阶段考试化学试卷
3 . 研究表明:质子溶剂参与苯乙烯环氧化反应机理如图所示(R表示烃基)。下列说法错误的是


| A.电负性:O>C>H | B.ROH与H2O2能形成分子间氢键 |
| C.ROH为反应过程的中间产物 | D.步骤③存在着极性键断裂和形成 |
您最近一年使用:0次
2023-07-28更新
|
95次组卷
|
4卷引用:河北省张家口市2022-2023学年高三上学期期末考试化学试题
解题方法
4 . 氨硼烷是一种特殊的化合物,分子式为 。氨硼烷在催化剂作用下水解释放氢气
。氨硼烷在催化剂作用下水解释放氢气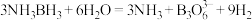 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题:_______
(2)写出 分子的电子式
分子的电子式_______
(3) 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(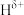 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(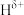 )。上述化学反应中,所含元素电负性由小到大的顺序为
)。上述化学反应中,所含元素电负性由小到大的顺序为_______ (填元素符号)
(4)有机碱离子 是
是 的等电子体,该离子与
的等电子体,该离子与 、
、 组成的光电材料,其晶胞如图所示:
组成的光电材料,其晶胞如图所示: 离子与
离子与 离子间的作用力为
离子间的作用力为_______ , 的配位数是
的配位数是_______ 。若晶胞参数为a pm,该晶体密度为ρ g⋅cm ,阿伏加德罗常数
,阿伏加德罗常数 可表示为
可表示为_______ mol (列出计算式)。
(列出计算式)。
 。氨硼烷在催化剂作用下水解释放氢气
。氨硼烷在催化剂作用下水解释放氢气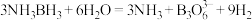 。
。 的结构如图。回答下列问题:
的结构如图。回答下列问题: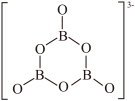
(2)写出
 分子的电子式
分子的电子式(3)
 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(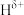 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(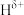 )。上述化学反应中,所含元素电负性由小到大的顺序为
)。上述化学反应中,所含元素电负性由小到大的顺序为(4)有机碱离子
 是
是 的等电子体,该离子与
的等电子体,该离子与 、
、 组成的光电材料,其晶胞如图所示:
组成的光电材料,其晶胞如图所示: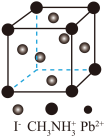
 离子与
离子与 离子间的作用力为
离子间的作用力为 的配位数是
的配位数是 ,阿伏加德罗常数
,阿伏加德罗常数 可表示为
可表示为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
5 . 向FeCl3溶液中滴加KSCN溶液,溶液呈血红色,下列说法正确的是
| A.电离能大小:I1(N)<I1(O) | B.半径大小:r(S2-)<r(K+) |
| C.电负性大小:χ(S)<χ(Cl) | D.酸性强弱:HNO3<H2CO3 |
您最近一年使用:0次
解题方法
6 . 短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”(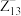 )具有40个价电子,下列说法不正确的是
)具有40个价电子,下列说法不正确的是
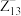 )具有40个价电子,下列说法不正确的是
)具有40个价电子,下列说法不正确的是| A.简单离子半径:Y>Z |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
C.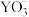 中心原子的杂化方式为sp3杂化 中心原子的杂化方式为sp3杂化 |
| D.X、Y、Z的电负性:Y>X>Z |
您最近一年使用:0次
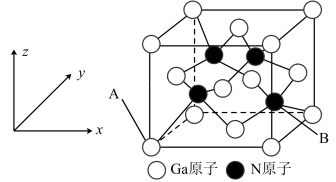
7 . 氮(N)、镓(Ga)合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
(2)晶胞中与同一个N原子相连的Ga原子构成的空间构型为___________ ,晶胞中与Ga原子相邻且最近的Ga原子个数为___________ 。
(3)以晶胞边长为单位长度建立的坐标系可以表示晶胞中的原子位置,称作原子分数坐标。A原子坐标为(0, ,
, ),则B原子坐标为
),则B原子坐标为___________ 。
(4)若GaN晶胞边长为apm,则Ga原子与N原子的最短核间距为___________ pm,该晶胞的密度为___________ g/cm3
(5)吡啶(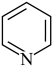 )是类似于苯的芳香族化合物。广义酸碱理论认为:凡能给出质子(
)是类似于苯的芳香族化合物。广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸:凡能结合质子(
)的任何分子或离子都是酸:凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶(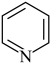 )属于
)属于___________ (填“酸”、“碱”或“盐”)。
| A.GaN晶体中存在非极性共价键 | B.电负性:N>Ga |
| C.原子半径:N>Ga | D.沸点:NH3>PH3 |
(3)以晶胞边长为单位长度建立的坐标系可以表示晶胞中的原子位置,称作原子分数坐标。A原子坐标为(0,
 ,
, ),则B原子坐标为
),则B原子坐标为(4)若GaN晶胞边长为apm,则Ga原子与N原子的最短核间距为
(5)吡啶(
 )是类似于苯的芳香族化合物。广义酸碱理论认为:凡能给出质子(
)是类似于苯的芳香族化合物。广义酸碱理论认为:凡能给出质子( )的任何分子或离子都是酸:凡能结合质子(
)的任何分子或离子都是酸:凡能结合质子( )的分子或离子都是碱。按此理论,吡啶(
)的分子或离子都是碱。按此理论,吡啶( )属于
)属于
您最近一年使用:0次
2023-07-21更新
|
138次组卷
|
4卷引用:吉林省“BEST合作体”2022-2023学年高二下学期期末联考化学试题
吉林省“BEST合作体”2022-2023学年高二下学期期末联考化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)(已下线)专题01 物质的结构与性质-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)综合01 物质结构与性质压轴40题-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
名校
解题方法
8 . 氢能源是一种不依赖化石燃料的储量丰富的清洁能源。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为___________ 。
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为___________ 。
②C、N、O的电负性的由大到小的顺序是___________ 。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是___________ 。
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷( )是一种潜在的储氢材料,可由
)是一种潜在的储氢材料,可由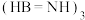 (结构为平面六元环状)通过如下反应制得:
(结构为平面六元环状)通过如下反应制得:
①从分子结构解释 、
、 、
、 的键角依次减小的原因
的键角依次减小的原因___________ 。
②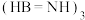 中N原子的杂化方式为
中N原子的杂化方式为___________ 。
③ 中N、B都达到稳定结构,
中N、B都达到稳定结构, 的结构式为(用→表示出配位键)
的结构式为(用→表示出配位键)___________ 。
(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为___________ 。
②已知: ;
; 表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为
表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为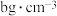 ,则该储氢材料的储氢能力为
,则该储氢材料的储氢能力为___________ (用含有a、b和 的代数式表示)。
的代数式表示)。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为
②C、N、O的电负性的由大到小的顺序是
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷(
 )是一种潜在的储氢材料,可由
)是一种潜在的储氢材料,可由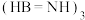 (结构为平面六元环状)通过如下反应制得:
(结构为平面六元环状)通过如下反应制得:
①从分子结构解释
 、
、 、
、 的键角依次减小的原因
的键角依次减小的原因②
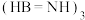 中N原子的杂化方式为
中N原子的杂化方式为③
 中N、B都达到稳定结构,
中N、B都达到稳定结构, 的结构式为(用→表示出配位键)
的结构式为(用→表示出配位键)(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为
②已知:
 ;
; 表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为
表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为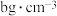 ,则该储氢材料的储氢能力为
,则该储氢材料的储氢能力为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
9 . 下列说法①和②均正确,但是说法①不能 正确解释说法②的是
| 选项 | 说法① | 说法② |
| A | 非金属性: | 酸性: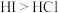 |
| B | 分子间作用力: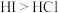 | 沸点: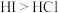 |
| C | 键能: | 稳定性: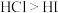 |
| D | 电负性: | 共价键极性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 根据所学知识,回答下列问题:
(1)键的极性对物质化学性质有影响,则① ②
②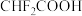 ③
③ ④
④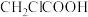 ,4种物质酸性由强到弱的顺序是
,4种物质酸性由强到弱的顺序是___________ (用序号表示)。
(2)一种含镓的药物合成方法如图所示:___________ mol。
②化合物Ⅱ中Ga的配位数为___________ ,
___________ 。
(3)对羟基苯甲醛(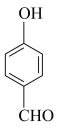 )的沸点比邻羟基苯甲醛(
)的沸点比邻羟基苯甲醛( )的沸点高,其原因是
)的沸点高,其原因是___________ 。
(4)甲胺分子常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为___________ 。
(5)乙二胺( )能与
)能与 等金属离子形成稳定环状离子,其原因是
等金属离子形成稳定环状离子,其原因是___________ 。
(6)具有 的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成
的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成 一羟基醛或
一羟基醛或 β一羟基酮。以乙醛为例,其过程可表示如下:
β一羟基酮。以乙醛为例,其过程可表示如下:___________ 。
(1)键的极性对物质化学性质有影响,则①
 ②
②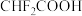 ③
③ ④
④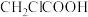 ,4种物质酸性由强到弱的顺序是
,4种物质酸性由强到弱的顺序是(2)一种含镓的药物合成方法如图所示:
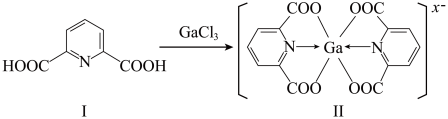
②化合物Ⅱ中Ga的配位数为

(3)对羟基苯甲醛(
 )的沸点比邻羟基苯甲醛(
)的沸点比邻羟基苯甲醛( )的沸点高,其原因是
)的沸点高,其原因是(4)甲胺分子常温常压下是一种无色有强刺激性气味的气体。甲胺极易溶于水除因为它们都是极性分子外,还因为
(5)乙二胺(
 )能与
)能与 等金属离子形成稳定环状离子,其原因是
等金属离子形成稳定环状离子,其原因是(6)具有
 的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成
的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合反应,生成 一羟基醛或
一羟基醛或 β一羟基酮。以乙醛为例,其过程可表示如下:
β一羟基酮。以乙醛为例,其过程可表示如下: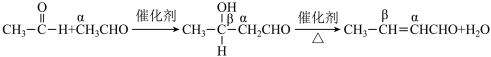
您最近一年使用:0次
2023-07-19更新
|
205次组卷
|
6卷引用:广东省清远市2022-2023学年高二下学期期末教学质量检测化学试题
广东省清远市2022-2023学年高二下学期期末教学质量检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县榆树实验,九台一中,前郭,农安2022-2023学年高二下学期7月期末考试化学试题吉林省两地六县重点中学2022-2023学年高二下学期期末联考化学试题河南省洛阳市创新发展联盟2023-2024学年高三上学期7月阶段性考试化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)综合01 物质结构与性质压轴40题-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)



