名校
解题方法
1 . Ⅰ.石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。已知:常温下H2S溶解度为1∶2.6(体积)。下图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
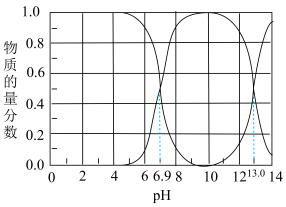
(1)由图判断,H2S的一级电离平衡常数为Ka1=___________ 。
(2)25℃,HS-电离程度小于水解程度,依据是:___________ 。
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是___________ 。
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:___________ 。
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是___________ 。
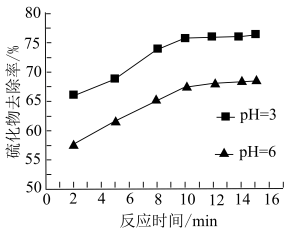
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:___________ 。
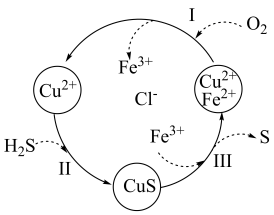
(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。
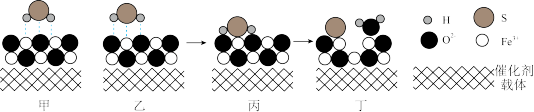
Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因___________ 。

(1)由图判断,H2S的一级电离平衡常数为Ka1=
(2)25℃,HS-电离程度小于水解程度,依据是:
(3)以酚酞为指示剂,将NaOH溶液滴入H2S溶液中,滴定终点的离子方程式是
(4)向pH≈9的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用平衡移动的原理解释溶液pH降低的原因:
Ⅱ.氧化还原法处理含HS-的废水:向含HS-的废水中加入一定浓度的Na2SO3溶液,加适量酸,溶液产生淡黄色沉淀。
(5)反应的离子方程式是
(6)不同pH时,硫化物去除率随时间的变化曲线如图所示。试分析本工艺选择控制体系的pH≈6,而不是去除率更高的pH=3的主要原因:

(7)处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是___________

| A.转化过程中参与循环的离子只有Fe2+ |
| B.转化过程有四种元素的化合价发生了变化 |
| C.过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ |
| D.氧化性由强到弱的顺序:O2 >Fe3+> S |
(8)催化重整法处理H2S。Fe2O3可以用作脱除H2S的催化剂,脱除过程如图所示。

Fe2O3脱除H2S时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度解释其原因
您最近一年使用:0次
名校
2 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)LiGaH4是一种温和的还原剂,其可由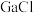 3和过量的LiH反应制得:
3和过量的LiH反应制得: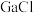 3
3 4
4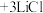 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③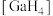 -的立体构型为
-的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示
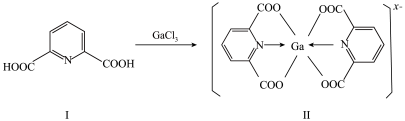
①化合物I中环上N原子的杂化方式为_______ ,1mol化合物Ⅰ中含有的σ键的物质的量为_______ 。化合物I中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:
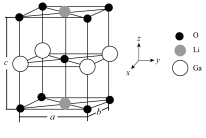
①上述晶胞沿着a轴的投影图为_______ (填选项字母)。
A.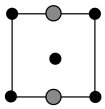 B.
B.  C.
C.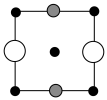
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由
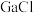 3和过量的LiH反应制得:
3和过量的LiH反应制得: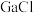 3
3 4
4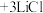 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
③
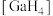 -的立体构型为
-的立体构型为(3)一种含镓的药物合成方法如图所示

①化合物I中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B.  C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为
您最近一年使用:0次
解题方法
3 . R、W、X、Y、Z是核电荷数依次增大的短周期主族元素,其形成的某种甜味剂的阴离子结构如图所示。已知X与W、Y位于同一周期且相邻,Y、Z位于同一主族。下列说法正确的是
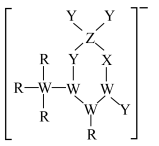

| A.电负性:Y>Z | B.简单离子半径:Z>Y>X |
| C.R与W形成的化合物均易溶于水 | D.Z的氧化物对应的水化物均为强酸 |
您最近一年使用:0次
名校
解题方法
4 . 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。
(1)基态碘原子的价电子排布式为___________ 。
(2)CH3NH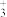 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为___________ 。
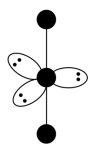
(3)I 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是___________ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。I 的空间构型为
的空间构型为___________ 。
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是___________ TiCl4至TiI4熔点依次升高,原因是___________ 。
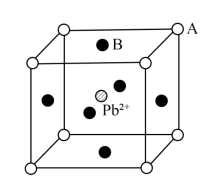
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有___________ 个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能 是___________ (填标号)。
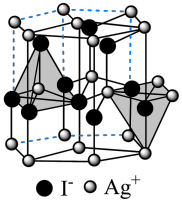
a.几何因素 b.电荷因素 c.键性因素
(1)基态碘原子的价电子排布式为
(2)CH3NH
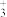 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为(3)I
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有

(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因

a.几何因素 b.电荷因素 c.键性因素
您最近一年使用:0次
解题方法
5 . 第三周期元素X、Y、Z的原子序数依次增大,25℃时,0.1mol/L它们最高价氧化物的水化物的溶液,对应的pH分别为13.00、1.57、0.70,下列有关说法正确的是
| A.原子半径:X<Y |
| B.元素电负性:Y<Z |
| C.Y的最高价氧化物的水化物属于强电解质 |
D.Z的最高价氧化物的水化物可能是 |
您最近一年使用:0次
6 . 黑火药是中国古代四大发明之一,其爆炸反应为 。下列有关说法正确的是
。下列有关说法正确的是
 。下列有关说法正确的是
。下列有关说法正确的是A.原子半径: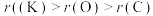 | B.电负性: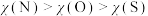 |
C.第一电离能: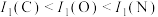 | D.简单氢化物的沸点: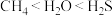 |
您最近一年使用:0次
2023-11-10更新
|
387次组卷
|
3卷引用:江苏省无锡市2023-2024学年高三上学期期中教学质量调研测试化学试卷题
7 . 铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 的核外电子排布式是
的核外电子排布式是___________ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确 的是___________ 。
A. 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2
B.化学键中离子键成分的百分数: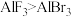
C. 分子中有6对共用电子对
分子中有6对共用电子对
D.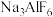 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构
②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是___________ 。
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是___________ 。
(3)AlP 晶胞结构如下图所示:
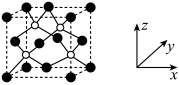
①磷化铝晶胞沿着 y轴的投影图为_________ (填选项字母)。
A. B.
B.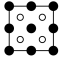 C.
C.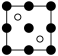 D.
D.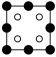
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为_________ g∙cm−3(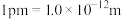 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
(1)能量最低的激发态
 的核外电子排布式是
的核外电子排布式是(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法
A.
 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2B.化学键中离子键成分的百分数:
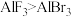
C.
 分子中有6对共用电子对
分子中有6对共用电子对D.
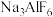 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是
(3)AlP 晶胞结构如下图所示:

①磷化铝晶胞沿着 y轴的投影图为
A.
 B.
B. C.
C. D.
D.
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为
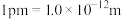 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
您最近一年使用:0次
名校
8 . 新能源是未来能源发展的方向,积极发展氢能是实现“碳达峰、碳中和”的重要举措。
(1)近年来CH4-H2O催化重整制氢是氢能源获取的重要途径,主要反应如下:
反应I:CH4(g)+H2O(g) 3H2(g)+CO(g) ΔH1
3H2(g)+CO(g) ΔH1
反应II:CO(g)+H2O(g) H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2
反应III:CH4(g)+2H2O(g) 4H2(g)+CO2(g) ΔH3
4H2(g)+CO2(g) ΔH3
甲烷水蒸气重整过程中自由能(ΔG=ΔH-TΔS,设ΔH和ΔS不随温度变化)随温度变化趋势如图1所示:_______ 0,ΔH2________ 0(填“>”或“<”)。
②1.01×105Pa下,将n起始(CH4):n起始(H2O)=1:1的混合气体置于密闭容器中,研究发现不同温度下重整体系中,800℃下H2平衡产率远大于600℃下H2平衡产率,其原因是_______ 。
(2)硼氢化钠(NaBH4)是一种高效储氢材料,25℃时NaBH4在掺杂了MoO3的纳米Co2B合金催化剂表面活性位点水解制氢的机理如图2所示:________ (用元素符号表示)。
②写出NaBH4与水反应生成NaBO2和H2的离子方程式________ ;并分析掺杂MoO3能提高制H2效率的原因________ 。
③已知25℃时NaBO2和NaBH4在水中的溶解度分别为28g和55g,NaBH4浓度对制H2速率影响如图3所示,NaBH4制H2的最佳浓度为10%,试分析浓度过低或过高反应速率变慢的原因_______ 。
(1)近年来CH4-H2O催化重整制氢是氢能源获取的重要途径,主要反应如下:
反应I:CH4(g)+H2O(g)
 3H2(g)+CO(g) ΔH1
3H2(g)+CO(g) ΔH1反应II:CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2反应III:CH4(g)+2H2O(g)
 4H2(g)+CO2(g) ΔH3
4H2(g)+CO2(g) ΔH3甲烷水蒸气重整过程中自由能(ΔG=ΔH-TΔS,设ΔH和ΔS不随温度变化)随温度变化趋势如图1所示:
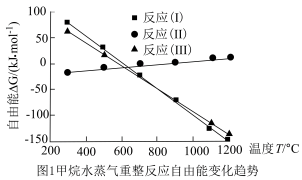
②1.01×105Pa下,将n起始(CH4):n起始(H2O)=1:1的混合气体置于密闭容器中,研究发现不同温度下重整体系中,800℃下H2平衡产率远大于600℃下H2平衡产率,其原因是
(2)硼氢化钠(NaBH4)是一种高效储氢材料,25℃时NaBH4在掺杂了MoO3的纳米Co2B合金催化剂表面活性位点水解制氢的机理如图2所示:
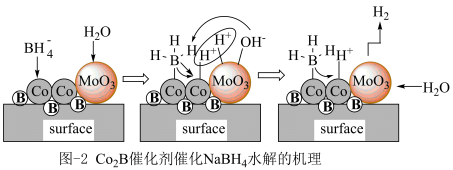
②写出NaBH4与水反应生成NaBO2和H2的离子方程式
③已知25℃时NaBO2和NaBH4在水中的溶解度分别为28g和55g,NaBH4浓度对制H2速率影响如图3所示,NaBH4制H2的最佳浓度为10%,试分析浓度过低或过高反应速率变慢的原因
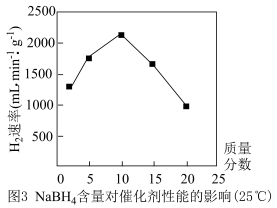
您最近一年使用:0次
2023-11-08更新
|
498次组卷
|
2卷引用:江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试题
解题方法
9 . 元素F、Cl、Br位于周期表中ⅦA族。下列有关说法正确的是
A.电离能: | B.电负性: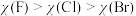 |
| C.氢化物的沸点:HF<HCl | D.键能:HF<HCl<HBr |
您最近一年使用:0次
解题方法
10 . 过渡元素锰能形成很多重要的化合物。三醋酸锰[(CH3CO0)3Mn)]是一种很好的有机反应氧化剂,可由硝酸锰晶体和乙酸酐反应制得:4Mn(NO3)2·6H2O+26(CH3CO)2O = 4(CH3COO)3Mn+8HNO2+3O2↑+ 40CH3COOH,请回答下列问题:
(1)CH3COOH中所含元素的电负性由大到小的顺序为___________ (用元素符号表示)。
(2) 的空间结构
的空间结构 ___________
(3)三醋酸锰[(CH3COO)3Mn)]中阳离子的价层电子的轨道表示式为___________ ,该价层排布式中电子的自旋状态 ___________ (填“相同”或“相反”)。
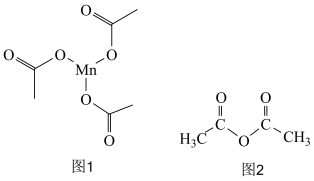
(4)三醋酸锰是一种配合物,其结构如图1所示,其中配位键数为___________ 。乙酸酐[(CH3CO)2O]可由CH3COOH在一定条件下脱水形成,其结构如图2所示,已知羧酸是一大类含羧基(-COOH)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释CH3COOH的酸性强于CH3CH2COOH的原因 ___________
(5)氮化锰的立方晶胞结构如图3所示,该晶胞的晶胞参数为anm,NA为阿伏加德罗常数的值。
①氮化锰的化学式为___________ 。
②该晶体的密度为___________ (用a、NA的代数式表示)。
(1)CH3COOH中所含元素的电负性由大到小的顺序为
(2)
 的空间结构
的空间结构 (3)三醋酸锰[(CH3COO)3Mn)]中阳离子的价层电子的轨道表示式为
(4)三醋酸锰是一种配合物,其结构如图1所示,其中配位键数为

(5)氮化锰的立方晶胞结构如图3所示,该晶胞的晶胞参数为anm,NA为阿伏加德罗常数的值。

①氮化锰的化学式为
②该晶体的密度为
您最近一年使用:0次



