名校
解题方法
1 . 如图表示不同类型共价键形成时电子云重叠情况:
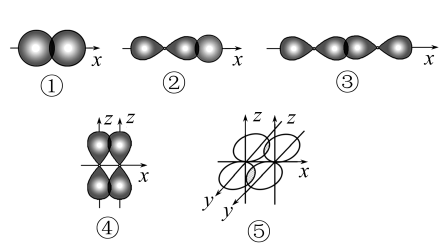
(1)其中形成的化学键属于镜面对称的有______ 。
(2)下列物质中,通过方式①化学键形成的是______ (填选项,下同);通过方式②化学键形成的是______ ;只通过方式③化学键形成的是_______ ;同时含有③、④、⑤三种方式化学键的物质是______ 。
A.Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如图:
甲: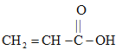 乙:CH2=CH2丙:CH2=CHCN
乙:CH2=CH2丙:CH2=CHCN
①甲分子中有______ 个σ键,______ 个π键。
②乙分子中______ (填“有”或“没有”)极性键,是______ 。(填“极性分子“”或“非极性分子”)
③丙分子中σ键与π键的数目之比为______ 。

(1)其中形成的化学键属于镜面对称的有
(2)下列物质中,通过方式①化学键形成的是
A.Cl2 B.HCl C.N2 D.H2
(3)甲、乙、丙三种有机物的结构如图:
甲:
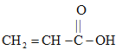 乙:CH2=CH2丙:CH2=CHCN
乙:CH2=CH2丙:CH2=CHCN①甲分子中有
②乙分子中
③丙分子中σ键与π键的数目之比为
您最近一年使用:0次
名校
2 . 肼(N2H4)又称联氨,是火箭常用的高能燃料,常温下为液体,其球棍分子模型如图所示。肼能与双氧水发生反应 N2H4+2H2O2=N2+4H2O,用 NA表示阿伏加 德罗常数的值。下列说法正确的是
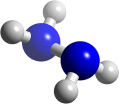

| A.N2H4属于共价化合物,分子中只含有极性共价键 |
| B.标准状况下,22.4 L N2H4中含有的原子总数为 6NA |
| C.标准状况下,3.2 g N2H4中含有共价键的总数为 0.6NA |
| D.若生成 3.6g H2O,则上述反应转移电子的数目为 0.2NA |
您最近一年使用:0次
2020-04-21更新
|
215次组卷
|
3卷引用:贵州省铜仁市思南中学2019-2020学年高二下学期5月考试化学试题
名校
3 . 下列有关化学键类型的判断不正确的是
| A.s—s σ键与s—p σ键的对称性相同 |
| B.分子中含有共价键,则至少含有一个σ键 |
| C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) |
| D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键 |
您最近一年使用:0次
2018-12-19更新
|
323次组卷
|
6卷引用:贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题
名校
4 . 下列关于有机物的说法不正确的是
①CH3—CH===CH—CH3和CH2===CH2为同系物
②CH≡CH和C6H6含碳量相同
③金刚石和石墨是同分异构体
④CH2Cl2有两种结构
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏伽德罗常数)
⑥C5H12有三种同分异构体
①CH3—CH===CH—CH3和CH2===CH2为同系物
②CH≡CH和C6H6含碳量相同
③金刚石和石墨是同分异构体
④CH2Cl2有两种结构
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏伽德罗常数)
⑥C5H12有三种同分异构体
| A.①②⑥ | B.③④⑤ | C.③④⑥ | D.③⑤⑥ |
您最近一年使用:0次
2019-02-19更新
|
227次组卷
|
3卷引用:贵州省思南中学2018-2019学年高二下学期期末考试化学试题
5 . 已知 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是
 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是A.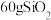 中含硅氧键数目为 中含硅氧键数目为 |
B.标准状况下,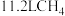 的分子数目为 的分子数目为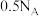 |
C.92g甲苯分子中含有 杂化的碳原子数目为 杂化的碳原子数目为 |
D. 溶液中阴离子数目大于 溶液中阴离子数目大于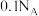 |
您最近一年使用:0次
6 . 已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________ (用化学式表示),原因是_____________________ 。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________ 。
(3)1 mol B2A2分子中含σ键的数目是____________ 。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____ 个原子,该晶体类型为________ 。
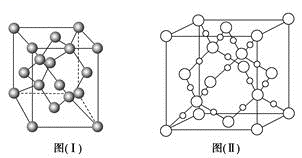
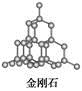
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________ 相结合,其晶胞中共有8个原子,其中在面心位置贡献______ 个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______ (填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________ 。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是
(3)1 mol B2A2分子中含σ键的数目是
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有


(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于
您最近一年使用:0次
解题方法
7 . “三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中被掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:

(1)写出基态碳原子的电子排布式______________ 。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是__________ 、__________ 、__________ 。
(3)一个三聚氰胺分子中有______ 个σ键。
(4)三聚氰胺与三聚氰酸( )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取
)分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取_________ 杂化。该分子的结构简式中,每个碳氧原子之间的共价键是_________ (填选项)。
a.2个σ键 b.2个π键 c.1个σ键,1个π键

(1)写出基态碳原子的电子排布式
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是
(3)一个三聚氰胺分子中有
(4)三聚氰胺与三聚氰酸(
 )分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取
)分子相互之间通过氢键结合,在肾脏内易形成结石。三聚氰酸分子中C原子采取a.2个σ键 b.2个π键 c.1个σ键,1个π键
您最近一年使用:0次
2018-02-11更新
|
219次组卷
|
2卷引用:贵州省息烽县一中2018-2019学年高二11月份考试化学试题
名校
8 . 下列有关σ键和π键的说法正确的是
| A.单键既有σ键也有π键 | B.所有的π键都容易打开 |
| C.σ键可沿键轴自由旋转而不影响键的强度 | D.π键比σ键重叠程度大,形成的共价键强 |
您最近一年使用:0次
2019-04-22更新
|
149次组卷
|
5卷引用:贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题
名校
解题方法
9 . 在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为________ 。
(2)写出Cu的核外电子排布式________ 。
(3)化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为________ 。
(4)在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为________ ;1mol尿素分子中,σ 键的数目为________ 。
(1)C、N、O的电负性由大到小的顺序为
(2)写出Cu的核外电子排布式
(3)化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为
(4)在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为
您最近一年使用:0次
2018-07-13更新
|
142次组卷
|
2卷引用:【全国百强校】贵州省思南中学2018-2019学年高二下学期第二次月考化学试题
10 . Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是________ 。
(2)从B分子的立体结构判断,该分子属于________ 分子(填“极性”或“非极性”)。
(3)C分子中都包含________ 个σ键,________ 个π键。
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):________ 。
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因:____________________ 。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为________ ,基态Cu原子的价电子排布式为________ 。
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________ (填晶体类型)。
(1)组成A分子的原子的元素符号是
(2)从B分子的立体结构判断,该分子属于
(3)C分子中都包含
(4)D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质):
Ⅱ.CO的结构可表示为CO,N2的结构可表示为NN。
(5)下表是两者的键能数据:(单位:kJ·mol-1)

结合数据说明CO比N2活泼的原因:
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为
(7)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
您最近一年使用:0次



