1 . 如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
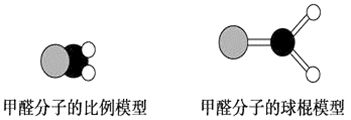
(1)甲醛分子中碳原子的杂化方式是__________ ,作出该判断的主要理由是__________________________ 。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________ (填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________ (填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________ 。

(1)甲醛分子中碳原子的杂化方式是
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角
您最近一年使用:0次
2018-12-15更新
|
1579次组卷
|
8卷引用:云南省河口县一中2018-2019学年高二上学期期中考试化学试题
云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题(已下线)专题11.2 分子结构与性质(练)-《2020年高考一轮复习讲练测》(人教版2019)选择性必修2 阶段性综合评估测试卷(一)鲁科版2019选择性必修2阶段性综合评估测试卷(一)高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节综合训练(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
名校
2 . ①PH3的分子构型为三角锥形,②BeCl2的分子构型为直线形,③CH4分子的构型为正四面体形,④CO2为直线形分子,⑤BF3分子构型为平面正三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是
| A.①⑥为极性分子,②③④⑤为非极性分子 |
| B.只有④为非极性分子,其余为极性分子 |
| C.只有②⑤是极性分子,其余为非极性分子 |
| D.只有①③是非极性分子,其余是极性分子 |
您最近一年使用:0次
2018-12-13更新
|
974次组卷
|
16卷引用:贵州省息烽县一中2018-2019学年高二上学期期中考试化学试题
贵州省息烽县一中2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题山东省临沂市罗庄区2019-2020学年高二下学期期中考试化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题云南省新平县一中2018-2019学年高二上学期12月考试化学试题(已下线)2019年3月18日 《每日一题》选修3-分子的极性云南省保山市昌宁县一中2019-2020学年高二10月月考化学试题四川省南充市白塔中学2019-2020学年高二12月月考化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题福建省福州市八县一中2019-2020学年高二年下学期适应性考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第二次阶段考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节 分子结构与物质的性质 课时1 共价键的极性黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题(已下线)第2章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)2.3.1 共价键的极性-随堂练习
12-13高二上·云南德宏·期中
名校
3 . 根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的是( )
| A.PCl3 | B.HCHO |
| C.H3O+ | D.PH3 |
您最近一年使用:0次
2018-08-01更新
|
433次组卷
|
13卷引用:2012-2013学年云南省芒市中学高二上学期期中考试化学试卷
(已下线)2012-2013学年云南省芒市中学高二上学期期中考试化学试卷贵州省思南中学2019-2020学年高二下学期期中考试化学试题吉林省通化县综合高级中学2020-2021学年高二下学期期中考试化学试题【全国百强校】陕西省西安中学2017-2018学年高二(实验班)下学期期末考试化学试题贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题(已下线)2019年3月7日 《每日一题》人教选修3-价层电子对互斥理论的应用【全国百强校】新疆乌鲁木齐市23中学2018-2019学年高二3月月考化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期第二次月考化学试题高二选择性必修2(人教版2019)第二章 分结构与性质 第二节 分子的空间结构 课时1 分子的空间结构 价层电子对互斥模型黑龙江省大庆市高中2020-2021学年高二下学期期末考试化学试题广东省清远市阳山县南阳中学2023-2024学年高二下学期第一次月考化学试题2.2.1 分子结构的测定和多样性 价层电子对互斥模型-课堂例题
名校
4 . 氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的VSEPR模型、分子的几何构型和中心原子(S)采取杂化方式的说法正确的是
| A.四面体形、三角锥形、sp3 | B.平面三角形、V形、sp2 |
| C.平面三角形、平面三角形、sp2 | D.四面体形、三角锥形、sp2 |
您最近一年使用:0次
2018-06-30更新
|
1747次组卷
|
7卷引用:【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题
名校
5 . 一种新型陶瓷的化学成分为BN晶体,该晶体具有高熔点、高硬度的特性,关于BN晶体的说法不正确的是( )
| A.该晶体为原子晶体,具有金刚石的结构特征 |
| B.该晶体中B的杂化类型是sp2杂化 |
| C.该晶体中存在配位键 |
| D.该晶体可作耐高温、耐磨材料 |
您最近一年使用:0次
2018-04-19更新
|
895次组卷
|
6卷引用:吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题
吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题浙江省宁波市北仑中学2021-2022学年高二上学期期中考试化学(育英班)试题安徽省滁州市定远县育才学校2021-2022学年高二分层班下学期期中考试化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二4月月考化学试题高二选择性必修2(人教版2019)第三章 晶体结构与性质 专题2 晶体类型的判断与晶胞结构的有关计算(已下线)3.2 分子晶体与共价晶体(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
名校
6 . 甲醛分子的结构式如图所示,用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是( )
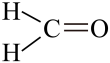

| A.甲醛分子中有4个σ键 |
| B.碳酰氯分子中的C原子为sp3杂化 |
| C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等 |
| D.碳酰氯分子为平面三角形,分子中存在一个π键 |
您最近一年使用:0次
2018-04-19更新
|
1093次组卷
|
6卷引用:山东省泰安市宁阳一中2020-2021学年高二下学期期中考试化学试题
山东省泰安市宁阳一中2020-2021学年高二下学期期中考试化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二4月月考化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构2.2.2分子的空间结构与分子性质(课前)-鲁科版选择性必修2
名校
7 . 下列分子中,各原子均处于同一平面上的是( )
| A.NH3 | B.CCl4 | C.PCl3 | D.CH2O |
您最近一年使用:0次
2018-02-12更新
|
232次组卷
|
4卷引用:吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题
吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.2 第1课时(已下线)模块同步卷05 分子的立体构型及分子的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题
名校
解题方法
8 . 用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是
A.BF 为正四面体形 为正四面体形 |
| B.CO2为直线形 |
| C.HCN为折线形(V形) |
D.SO 为三角锥形 为三角锥形 |
您最近一年使用:0次
2018-02-10更新
|
247次组卷
|
2卷引用:内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期期中考试化学试题
名校
9 . 下列说法正确的是( )
| A.SO2 与CO2的分子立体构型均为直线形 |
| B.H2O和NH3 中的中心原子杂化方式相同 |
| C.SiO2的键长大于CO2的键长,所以SiO2的熔点比CO2高 |
| D.分子晶体中只存在分子间作用力,不含有其它化学键 |
您最近一年使用:0次
2017-12-02更新
|
1209次组卷
|
8卷引用:四川省雅安中学2017-2018学年高二上学期期中考试化学试题
名校
10 . 以下是一些分子的比例模型,其中空间结构和原子大小比例错误 的是
A.NH3 |
B.H2O |
C.HCl |
D.CCl4 |
您最近一年使用:0次
2017-04-22更新
|
203次组卷
|
4卷引用:2016-2017学年江苏省沭阳县高一下学期期中调研测试化学试卷



