名校
解题方法
1 . 溶剂是影响化学反应的重要因素之一,当反应在无溶剂条件下进行时,具有操作简单、反应时间短、无溶剂浪费且遵循绿色化学的原理等独特优点。因此,无溶剂不对称催化已成为合成化学中的重要课题。化合物H是一种手性有机催化剂,可无溶剂催化如下迈克尔加成反应(Michael addition reaction): 、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
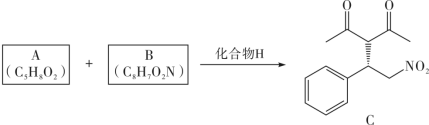
(1)A的化学名称为___________ ;B为反式结构,其结构简式为___________ 。
(2)已知E的核磁共振氢谱只有一个吸收峰。写出D(用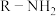 简化表示)与E反应的化学方程式
简化表示)与E反应的化学方程式___________ ,该反应类型为___________ 。
(3)G的同分异构体中,含有碳、氮环状骨架为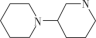 的共有
的共有___________ 种(不含立体异构)。
(4)推测H催化A和B反应的部分机理可能为:A异构化为烯醇(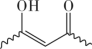 ),再和B与催化剂H结合(如图所示,
),再和B与催化剂H结合(如图所示, 表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的
表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的___________ (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键___________ 。
(5)如果要合成H的类似物H′(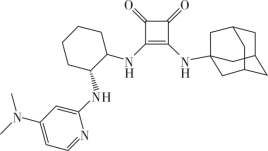 ),参照上述合成路线,写出相应的G′的结构简式
),参照上述合成路线,写出相应的G′的结构简式___________ 。以甲苯为溶剂,H′可催化A与B的迈克尔加成反应,产物主要是___________ (填“C”“C的手性异构体”或“C及其手性异构体各占50%”),判断理由是___________ 。
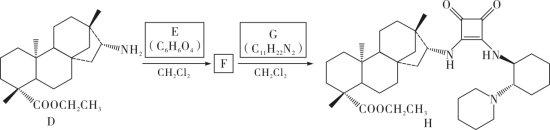
化合物H的合成路线如下( 、
、 分别表示由纸面向内、向外伸展的共价键):
分别表示由纸面向内、向外伸展的共价键):
 、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体
、R(大)、R′(小)顺时针排列的面称为Re-face(下图左),逆时针排列的面称为Si-face(下图右),—R″进攻不同面β-碳的产物互为手性异构体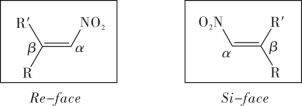
(1)A的化学名称为
(2)已知E的核磁共振氢谱只有一个吸收峰。写出D(用
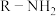 简化表示)与E反应的化学方程式
简化表示)与E反应的化学方程式(3)G的同分异构体中,含有碳、氮环状骨架为
 的共有
的共有(4)推测H催化A和B反应的部分机理可能为:A异构化为烯醇(
 ),再和B与催化剂H结合(如图所示,
),再和B与催化剂H结合(如图所示,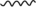 表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的
表示链的延长)。反应物与催化剂H结合的作用力主要是下列中的a.离子键 b.共价键 c.配位键 d.氢键
(5)如果要合成H的类似物H′(
 ),参照上述合成路线,写出相应的G′的结构简式
),参照上述合成路线,写出相应的G′的结构简式
您最近一年使用:0次
解题方法
2 . 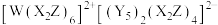 是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
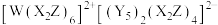 是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是
是合成某种全氮阴离子配合物所需的中间体。其中,X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素基态原子的电子只有一种自旋取向,Y与Z是同周期相邻非金属元素,且Y的第一电离能大于Z。下列说法正确的是| A.简单氢化物的沸点:Y>Z |
| B.简单离子的半径:W>Z>Y>X |
C.1mol该中间体中含 键的数目为 键的数目为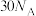 |
D. 分子的VSEPR模型名称为四面体 分子的VSEPR模型名称为四面体 |
您最近一年使用:0次
解题方法
3 . X、Y、Z、W是原子序数依次增大的前四周期元素,X元素的简单氢化物能与其最高价氧化物对应水化物反应生成盐; Y元素原子的核外电子只有8种运动状态;Z为短周期金属元素,其简单离子的半径在同周期中最小;基态W原子的未成对电子数为6。下列说法错误的是
| A.第一电离能: X>Y> Z |
B.键角 > > |
| C.W为第四周期d区元素 |
| D.X和Y的最简单气态氢化物中,前者更易液化 |
您最近一年使用:0次
解题方法
4 . 2020年3月29日,比亚迪发布刀片电池,该电池不但大幅提高了体积利用率,并且顺利通过了安全性能的“针刺测试”,其使用的磷酸铁锂电池的工作原理为LiFePO4 +C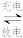 Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
(1)LiFePO4中基态铁粒子的核外电子排布式为_______ ,Fe原子的所有能级中能量最高的能级是_______ 。
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为_______ ,NH3的键角略大于PH3,从原子结构角度说明原因_______ 。
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为_______ ,其中PCl3的沸点_______ (填“大于”或“小于”)PCl5。
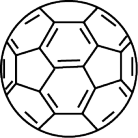
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含_______ 个π键。
(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为_______ 。
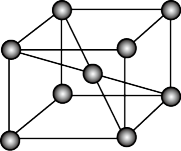
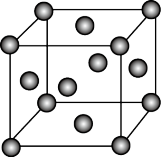
(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为_______ m(用代数式表示)。

 Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:
Li1-xFePO4 +LixC,已知:NA代表阿伏加德罗常数的值。回答下列问题:(1)LiFePO4中基态铁粒子的核外电子排布式为
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P三种元素中,电负性由大到小的顺序为
(3)磷的氯化物有两种: PCl3和 PCl5, PCl3的VSEPR模型为
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图所示,2mol足球烯含

(5)锂、铁单质晶胞分别如左图、右图所示,锂、铁晶胞的配位数之比为


(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρg·cm-3,金刚石中C—C键的键长为

您最近一年使用:0次
2022-07-26更新
|
446次组卷
|
2卷引用:云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题
解题方法
5 . 早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________ ,属于_____ 区,基态Ag原子的价电子排布式为__________ 。
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是______ (填名称),配体阴离子的空间构型是______ ,中心原子采用_____ 杂化。
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4_____ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为______ (用化学式表示),其结构原因是______ 。
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ 。
a. 几何因素 b. 电荷因素 c. 键性因素

(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)=______________ 。
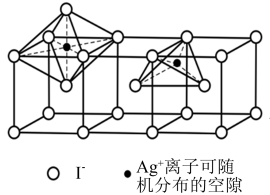
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
a. 几何因素 b. 电荷因素 c. 键性因素

(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)=

您最近一年使用:0次
2020-06-20更新
|
504次组卷
|
2卷引用:云南省2020届高三适应性考试理科综合化学(A卷)试题
解题方法
6 .  、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________ 。
(2) 有
有________ 几种不同的运动状态的电子, 比
比 更稳定的原因是
更稳定的原因是_________ 。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________ (用元素符号表示)。
(4) 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于______ 晶体。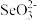 的空间构型为
的空间构型为_____ 。
(5)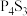 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。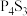 分子中S的杂化方式为
分子中S的杂化方式为______ 。每个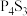 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为_________ 。

(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________ 。若该晶胞的边长为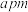 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为_________ 
 、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:(1)钴原子的基态电子排布式为
(2)
 有
有 比
比 更稳定的原因是
更稳定的原因是(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为
(4)
 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于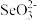 的空间构型为
的空间构型为(5)
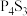 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。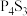 分子中S的杂化方式为
分子中S的杂化方式为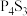 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为
(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为
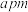 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为
您最近一年使用:0次



