解题方法
1 . 碳元素的单质有多种形式,如图所示,依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为______ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为______ 、______ 。
(3)C60属于_____ 晶体,石墨属于______ 晶体。
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为______ ;每个Cs+周围距离相等且次近的Cs+数目为______ ,距离为______ ;每个Cs+周围距离相等且第三近的Cs+数目为______ ,距离为______ ;每个Cs+周围紧邻且等距的Cl—数目为______ 。


回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)根据CsCl的晶胞结构分析,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为

您最近一年使用:0次
解题方法
2 . 氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的用途。请回答下列问题:
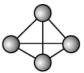
(1)科学家目前合成了 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是_______ ,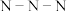 键角为
键角为_______ ; 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为_______ 。
(2)①维生素 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
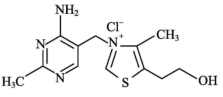
以下关于维生素 的说法正确的是
的说法正确的是_______ 。
a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有_______ 。
(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①_______ ;②极性键;③_______ 。
(1)科学家目前合成了
 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是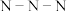 键角为
键角为 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为
(2)①维生素
 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
以下关于维生素
 的说法正确的是
的说法正确的是a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素
 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨
 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
您最近一年使用:0次
名校
解题方法
3 . 填空。
(1) 分子中,P的杂化方式
分子中,P的杂化方式_______ 。
(2)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①从结构角度分析,R中两种阳离子的相同之处为_______ 。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.空间结构D.共价键类型
②R中阴离子 中的
中的 键总数为
键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_______ 。
③图中虚线代表氢键,其表示式为 、
、 、
、_______ 。
(1)
 分子中,P的杂化方式
分子中,P的杂化方式(2)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①从结构角度分析,R中两种阳离子的相同之处为
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.空间结构D.共价键类型
②R中阴离子
 中的
中的 键总数为
键总数为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为③图中虚线代表氢键,其表示式为
 、
、 、
、
您最近一年使用:0次
名校
解题方法
4 . 完成下列问题。
(1) 是有机合成中常用的还原剂。
是有机合成中常用的还原剂。 中,存在_______(填标号)。
中,存在_______(填标号)。
(2)气态三氧化硫以单分子形式存在,其中按轨道重叠方式分类共价键的类型有_______ 种。
(3)等电子体的结构相似、物理性质相近,称为等电子原理。如 和CO为等电子体。试回答:
和CO为等电子体。试回答:
①写出下面物质分子或离子的立体构型:

_______ ,
_______ 。
②由第二周期元素组成,与 互为等电子体的离子有
互为等电子体的离子有_______ 。
③ 的立体构型如图1所示,请再按照图1的表示方法在图2中表示
的立体构型如图1所示,请再按照图1的表示方法在图2中表示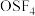 分子中O、S、F原子的空间位置
分子中O、S、F原子的空间位置_______ 。已知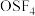 分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
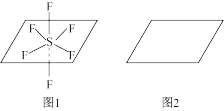
(4)氨气在水中的溶解度远大于甲烷,原因是_______ (答出三条)。
(1)
 是有机合成中常用的还原剂。
是有机合成中常用的还原剂。 中,存在_______(填标号)。
中,存在_______(填标号)。| A.离子键 | B.σ键 | C.π键 | D.氢键 |
(3)等电子体的结构相似、物理性质相近,称为等电子原理。如
 和CO为等电子体。试回答:
和CO为等电子体。试回答:①写出下面物质分子或离子的立体构型:


②由第二周期元素组成,与
 互为等电子体的离子有
互为等电子体的离子有③
 的立体构型如图1所示,请再按照图1的表示方法在图2中表示
的立体构型如图1所示,请再按照图1的表示方法在图2中表示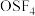 分子中O、S、F原子的空间位置
分子中O、S、F原子的空间位置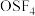 分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)
分子中O、S间为共价双键,S、F间为共价单键。(已知三键斥力>双键斥力>单键斥力)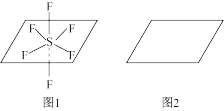
(4)氨气在水中的溶解度远大于甲烷,原因是
您最近一年使用:0次
名校
5 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置___________ ,有___________ 种能量不同的电子,电子占据的最高能层符号是___________
(2)Ni的价电子轨道表示式为___________ ,属于___________ 区的元素
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为___________

(1)Mn在元素周期表中的位置
(2)Ni的价电子轨道表示式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,S的轨道杂化方式为
您最近一年使用:0次
名校
解题方法
6 . 钛及其化合物作用重要,尤其氧化钛、四氧化钛、钛酸钡等应用更广。回答下列问题:
(1)基态钛原子的价层电子排布式为_______ 。
(2) 二氧化钛是世界上最白的物质,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中核外电子占据的原子轨道数为_____ 个。
(3)四氯化钛是种有趣的液体,在潮湿空气中水解生成白色的二氧化钛水凝胶,军事上利用四氯化钛的这种“怪脾气”制造烟雾剂。写出四氯化钛水解的化学方程式_______ 。
(4)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。LiBH4由Li+和BH 构成,其中BH
构成,其中BH 的空间构型为
的空间构型为_______ ;B原子的杂化轨道类型为_______ 。
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
锰元素位于第_______ 周期_______ 族_______ 区;比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)基态钛原子的价层电子排布式为
(2) 二氧化钛是世界上最白的物质,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中核外电子占据的原子轨道数为
(3)四氯化钛是种有趣的液体,在潮湿空气中水解生成白色的二氧化钛水凝胶,军事上利用四氯化钛的这种“怪脾气”制造烟雾剂。写出四氯化钛水解的化学方程式
(4)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。LiBH4由Li+和BH
 构成,其中BH
构成,其中BH 的空间构型为
的空间构型为(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
元素 | Mn | Fe | |
电离能/kJ∙mol−1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
您最近一年使用:0次
2022-01-17更新
|
306次组卷
|
3卷引用:吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题
吉林省抚松县第一中学2021-2022学年高二下学期开学考试化学试题湖南省怀化市2021-2022学年高二上学期期末考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)



