名校
1 . 下列关于杯酚分离  和
和  的说法错误的是
的说法错误的是
 和
和  的说法错误的是
的说法错误的是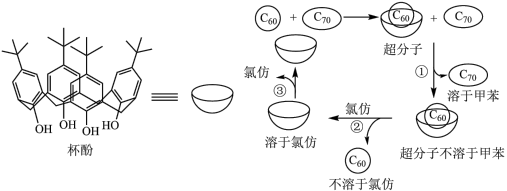
A.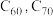 均属于非极性分子,而氯仿属于极性分子 均属于非极性分子,而氯仿属于极性分子 |
| B.操作①②是过滤,操作③是蒸馏 |
C.“杯酚”与  之间利用共价键结合在一起 之间利用共价键结合在一起 |
D.“杯酚”分离  和 和  这个案例体现了超分子具有分子识别这个重要特征 这个案例体现了超分子具有分子识别这个重要特征 |
您最近一年使用:0次
解题方法
2 . 一种工业洗涤剂中间体结构式如图所示,其中短周期元素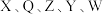 原子序数依次增大,
原子序数依次增大, 和
和 同主族但不相邻,
同主族但不相邻,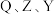 为相邻元素,
为相邻元素, 和
和 最外层电子数之和是
最外层电子数之和是 原子
原子 层电子数的二倍,下列说法正确的是
层电子数的二倍,下列说法正确的是
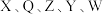 原子序数依次增大,
原子序数依次增大, 和
和 同主族但不相邻,
同主族但不相邻,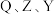 为相邻元素,
为相邻元素, 和
和 最外层电子数之和是
最外层电子数之和是 原子
原子 层电子数的二倍,下列说法正确的是
层电子数的二倍,下列说法正确的是
A. 和 和 均为极性分子 均为极性分子 | B.第一电离能: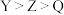 |
C.原子半径: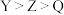 | D.W与 形成的化合物中只含离子键 形成的化合物中只含离子键 |
您最近一年使用:0次
名校
解题方法
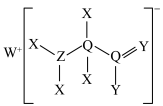
3 . 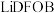 是一种新型的电解质锂盐,具有较高的电化学稳定性和电导率,被广泛用于目前的锂电池中。
是一种新型的电解质锂盐,具有较高的电化学稳定性和电导率,被广泛用于目前的锂电池中。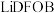 的结构如图所示,其中元素M、X、Y、Z位于同一短周期,X原子核外的s轨道与p轨道上的电子数之比为
的结构如图所示,其中元素M、X、Y、Z位于同一短周期,X原子核外的s轨道与p轨道上的电子数之比为 ,下列叙述正确的是
,下列叙述正确的是
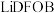 是一种新型的电解质锂盐,具有较高的电化学稳定性和电导率,被广泛用于目前的锂电池中。
是一种新型的电解质锂盐,具有较高的电化学稳定性和电导率,被广泛用于目前的锂电池中。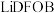 的结构如图所示,其中元素M、X、Y、Z位于同一短周期,X原子核外的s轨道与p轨道上的电子数之比为
的结构如图所示,其中元素M、X、Y、Z位于同一短周期,X原子核外的s轨道与p轨道上的电子数之比为 ,下列叙述正确的是
,下列叙述正确的是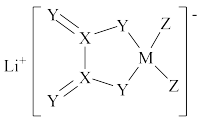
| A.X、Y、Z的简单气态氢化物分子之间均能形成氢键 |
| B.X、Y两元素组成的分子一定为极性分子 |
C.该化合物形成的晶体熔点比 晶体高 晶体高 |
| D.该化合物中有极性键、非极性键、配位键和离子键 |
您最近一年使用:0次
2023-12-05更新
|
1091次组卷
|
5卷引用:黑龙江省肇东市第四中学2023-2024学年高三上学期期末考试化学试题
黑龙江省肇东市第四中学2023-2024学年高三上学期期末考试化学试题2024新东方高二上期末考化学03吉林省长春市2024届高三上学期质量监测(一)化学试题辽宁省沈阳市第一二0中学2023-2024学年高三上学期第五次质量监测化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
4 . CrO2Cl2可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。下列说法正确的是
| A.CCl4为极性分子 | B.熔点:KCl>COCl2 |
| C.电负性:C>Cl | D.KCl含有非极性键 |
您最近一年使用:0次
2023-09-24更新
|
45次组卷
|
2卷引用:黑龙江省哈尔滨市2023-2024学年高三上学期六校联考化学试题
名校
5 . 下列关于物质的结构或性质及解释都正确的是
| 物质的结构或性质 | 解释 | |
| A | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醛分子间范德华力更强 |
| B | 熔点:SiO2>CO2 | 相对分子质量:SiO2大于CO2 |
| C | O2与O3分子极性相同 | 二者都是由非极性键构成的分子 |
| D | 酸性:CF3COOH>CCl3COOH | CF3COOH的羧基中羟基的极性更大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 下列对一些实验事实的理论解释,正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 溴单质、碘单质在四氯化碳中的溶解度比在水中大 | 溴单质、碘单质和四氯化碳都为极性分子 |
| B | 卤素单质从F2到I2,在常温、常压下的聚集状态由气态、液态到固态 | 范德华力逐渐减小 |
| C | 在常温常压下,1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键影响 |
| D | HF的沸点高于HCl | H-F的键长比H-Cl的短 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-06更新
|
312次组卷
|
2卷引用:黑龙江省大庆铁人中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如图所示。则下列判断错误的是
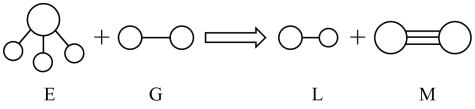

| A.G和M都含σ键和π键 |
| B.E能使紫色石蕊溶液变蓝 |
| C.L是极性分子 |
| D.G和M都是非极性分子 |
您最近一年使用:0次
名校
解题方法
8 . 下列说法中不正确的是
| A.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数 |
| B.三氟乙酸的酸性大于三氯乙酸是由于键的极性不同导致电离出氢离子能力不同 |
| C.对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键 |
| D.氯气易溶于氢氧化钠溶液是因为“相似相溶”规律导致的 |
您最近一年使用:0次
2023-03-06更新
|
289次组卷
|
3卷引用:黑龙江省大庆铁人中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 下列物质中,由极性键构成的非极性分子是
A. | B. | C. | D. |
您最近一年使用:0次
2023-02-19更新
|
160次组卷
|
2卷引用:黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
10 . 生产生活中处处有化学,结合物质与结构的相关知识,回答下列问题:
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示
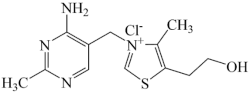
①C元素基态原子核外电子有_______ 种运动状态,其中电子占据能量最高的能级符号为_______ 。
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有_______ 。(填序号)
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有_______ 。(填化学式)
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①_______ ;②极性键;③_______ 。
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应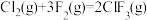 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为_______ kJ/mol。ClF3的熔、沸点比BrF3的_______ (填“高”或“低”)。
(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因_______ 。
(5)氯丙烯分子(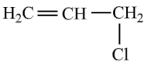 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是_______ 。
(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。
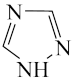
1 mol Bipy中含有σ键_______ mol。
(1)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示

①C元素基态原子核外电子有
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有
a.离子键、共价键 b.离子键、氢键、共价键
c.氢键、范德华力 d.离子键、氢键、范德华力
③维生素B1燃烧可生成N2、NH3、CO2、SO2、H2O、HCl等物质,这些物质中属于非极性分子的化合物有
(2)液氨常被用作制冷剂,若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的主要相互作用是①
(3)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应
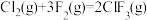 △H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为
△H=-313 kJ/mol,F-F键的键能为159 kJ/mol,Cl-Cl键的键能为242 kJ/mol,则ClF3中Cl-F键的平均键能为(4)TiCl4稳定性比CCl4差,极易水解,试从结构分析其原因
(5)氯丙烯分子(
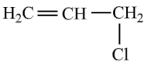 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是(6)铁能与三氮唑(Bipy,结构如图)形成多种化合物。

1 mol Bipy中含有σ键
您最近一年使用:0次



