名校
1 . 海水是巨大的资源宝库。下图是从海水中提取食盐和溴的主要流程。

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
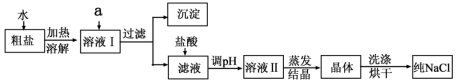
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_____________ 、_____________ ;
②如何证明操作①中NaOH溶液已经过量?_______________________________________
③蒸发过程所用的主要仪器有:铁架台、酒精灯、_______________________ ;
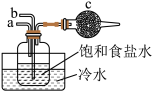
(2)某同学欲用四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的具体操作 是:______ 。②分离碘的四氯化碳溶液的操作方法 是:________ 。
(3)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性。水的沸点为100℃。他们参观生产过程后,设计了如下装置简图:

①图中仪器B的名称:__________ 。
②用热水浴加热的优点是:________ 。
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:____ 。

(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、
②如何证明操作①中NaOH溶液已经过量?
③蒸发过程所用的主要仪器有:铁架台、酒精灯、
(2)某同学欲用四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的
(3)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性。水的沸点为100℃。他们参观生产过程后,设计了如下装置简图:

①图中仪器B的名称:
②用热水浴加热的优点是:
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:
您最近一年使用:0次
2017-12-01更新
|
225次组卷
|
3卷引用:黑龙江省大庆市铁人中学2018-2019学年高一下学期开学考试化学试题
名校
2 . 锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________ (任写一种)。请写出其中发生的氧化还原反应离子方程式: _________ 。滤渣的成分为S单质和_________ 。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________ 。
(3) 简述检验沉淀是否洗净的实验方法:_________ ,若未出现浑浊则证明沉淀已洗干净,反之则没有。

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O
 Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):(3) 简述检验沉淀是否洗净的实验方法:
您最近一年使用:0次
2017-08-26更新
|
226次组卷
|
2卷引用:江西省南昌市2018届高三摸底调研考试化学试题
名校
3 . 某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
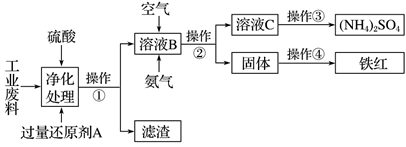
回答下列问题:
(1)滤渣的成分为________ ,操作②的名称为_____________________ 。
(2)上图溶液B中所发生反应的离子方程式为____________________________ 。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是____________________________________________________ 。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要_______________ 。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
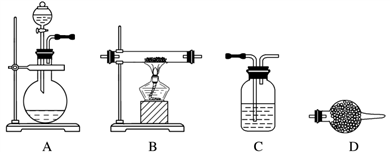
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________ →________ →________ →D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为____________ ,其作用是________________________ 。
②点燃B处酒精灯之前必须进行的操作是____________________________ 。

回答下列问题:
(1)滤渣的成分为
(2)上图溶液B中所发生反应的离子方程式为
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。

①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→
②点燃B处酒精灯之前必须进行的操作是
您最近一年使用:0次
2017-06-27更新
|
1317次组卷
|
3卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020届高三上学期开学考试(8月)化学试题
名校
4 . 含钠化合物在工业生产和日常生活中应用广泛,请回答下列有关问题:
(1)钠元素的碱性氧化物的化学式为___________ ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个化学方程式:___________ 。
(2) 是一种强碱,若实验室用
是一种强碱,若实验室用 浓溶液配制
浓溶液配制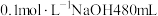 ,需量取密度为
,需量取密度为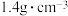 质量分数为
质量分数为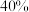 的
的 溶液
溶液___________  ,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有
,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有___________ ,当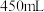 所配溶液与标准状况下
所配溶液与标准状况下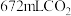 恰好反应时,发生反应的离子方程式为
恰好反应时,发生反应的离子方程式为___________ 。
(3)如图是实验室模拟“侯氏制碱法”制取 的部分装置。下列说正确的是___________(填序号)
的部分装置。下列说正确的是___________(填序号)
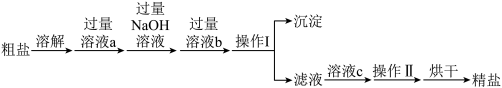
(4)粗盐常含有少量 、
、 、
、 以及泥沙等杂质,实验室中可用如下流程提纯
以及泥沙等杂质,实验室中可用如下流程提纯 ,下列说法中正确的是___________(填序号)
,下列说法中正确的是___________(填序号)
(1)钠元素的碱性氧化物的化学式为
(2)
 是一种强碱,若实验室用
是一种强碱,若实验室用 浓溶液配制
浓溶液配制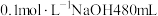 ,需量取密度为
,需量取密度为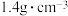 质量分数为
质量分数为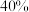 的
的 溶液
溶液 ,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有
,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有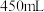 所配溶液与标准状况下
所配溶液与标准状况下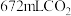 恰好反应时,发生反应的离子方程式为
恰好反应时,发生反应的离子方程式为(3)如图是实验室模拟“侯氏制碱法”制取
 的部分装置。下列说正确的是___________(填序号)
的部分装置。下列说正确的是___________(填序号)
A.a先通入 ,然后b通入 ,然后b通入 ,c中放碱石灰 ,c中放碱石灰 |
B.b先通入 ,然后a通入 ,然后a通入 ,c中放碱石灰 ,c中放碱石灰 |
C.a先通入 ,然后b通入 ,然后b通入 ,c中放蘸稀硫酸的脱脂棉 ,c中放蘸稀硫酸的脱脂棉 |
D.b先通入 ,然后a通入 ,然后a通入 ,c中放蘸稀硫酸的脱脂棉 ,c中放蘸稀硫酸的脱脂棉 |
 、
、 、
、 以及泥沙等杂质,实验室中可用如下流程提纯
以及泥沙等杂质,实验室中可用如下流程提纯 ,下列说法中正确的是___________(填序号)
,下列说法中正确的是___________(填序号)
A.溶液a和 可用一种试剂来代替 可用一种试剂来代替 |
| B.溶液a和溶液b的添加顺序可以互换 |
| C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热 |
| D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒 |
您最近一年使用:0次
2023-02-12更新
|
392次组卷
|
3卷引用:山东省德州市2022-2023学年高一下学期开学考试化学试题
5 . 金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)一定条件下,Na与CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为____ 。推测该反应的类型为____ 。(填标号)
A..分解反应 B.置换反应 C.氧化还原反应 D.离子反应
(2)已知:Si+2NaOH+H2O===Na2SiO3+2H2↑。在高温电炉中碳和SiO2反应可制得SiC,同时生成CO,其粗产品中杂质为Si和SiO2。
①请写出电炉中所发生反应的化学方程式:___________ ,每有1 mol SiC生成时,转移电子的物质的量为____ 。
②现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L,则硅酸盐的物质的量浓度为______ 。
(3)下列关于金刚石、SiC和单质Si的说法不正确 的是_____ 。(填标号)
A.金刚石、SiC和单质Si都属于无机非金属材料
B.金刚石和石墨、晶体硅和无定形硅分别互为同素异形体
C.金刚石和单质硅都是良好的半导体材料
D.金刚石、SiC和Si晶体结构类似
(1)一定条件下,Na与CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为
A..分解反应 B.置换反应 C.氧化还原反应 D.离子反应
(2)已知:Si+2NaOH+H2O===Na2SiO3+2H2↑。在高温电炉中碳和SiO2反应可制得SiC,同时生成CO,其粗产品中杂质为Si和SiO2。
①请写出电炉中所发生反应的化学方程式:
②现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L,则硅酸盐的物质的量浓度为
(3)下列关于金刚石、SiC和单质Si的说法
A.金刚石、SiC和单质Si都属于无机非金属材料
B.金刚石和石墨、晶体硅和无定形硅分别互为同素异形体
C.金刚石和单质硅都是良好的半导体材料
D.金刚石、SiC和Si晶体结构类似
您最近一年使用:0次



