1 .  是一种重要的无机功能材料,将粗
是一种重要的无机功能材料,将粗 (含较多
(含较多 和
和 杂质)样品提纯的工艺路线如下。
杂质)样品提纯的工艺路线如下。
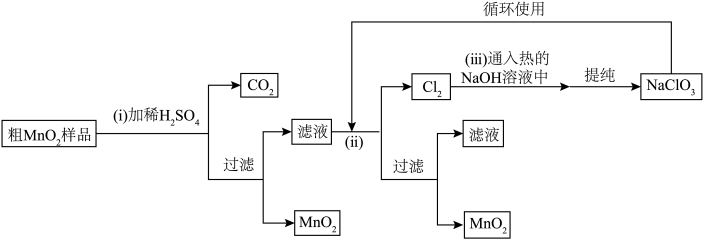
按要求回答下列问题:
(1)本实验第(ⅰ)步需要用 的稀
的稀 ,现采用市售浓硫酸来配制该溶液。
,现采用市售浓硫酸来配制该溶液。
①配制该溶液时,除烧杯、量筒、玻璃棒外,还缺少的玻璃仪器是___________ (填写名称)。
②如图为市售浓硫酸试剂瓶上所贴标签的部分内容。经计算,本配制实验需要用量筒量取该浓硫酸的体积为___________  。
。
③下列操作会使配得的硫酸溶液浓度偏低的是___________ (填标号)。
a.量取浓硫酸时俯视量筒的刻度线
b.定容时俯视容量瓶的度线
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时酒到容量瓶外,继续用该未清洗的容量瓶重新配制
④使用浓硫酸时,存在一定的安全风险。实验方案中出现的图标 和
和 ,前者提示实验者结束实验后需清洗双手,后者要求实验者
,前者提示实验者结束实验后需清洗双手,后者要求实验者___________ (填防护措施)。关于实验操作及实验室突发事件的应对措施,下列说法正确的是___________ (填标号)。
a.稀释浓硫酸时,应将水缓慢注入浓硫酸中,并不断搅拌
b.皮肤溅上酸液,先用大量水冲洗,再涂上3%~5%的硼酸溶液
c.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
d.少量酸滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布
(2)第(ⅰ)步加稀 时,粗
时,粗 样品中的
样品中的___________ (写出化学式)转化为可溶性物质。
(3)第一次过滤后,所得 需要洗涤,判断其已洗涤干净的方法是
需要洗涤,判断其已洗涤干净的方法是___________ 。
(4)完成第(ⅱ)步相关的离子反应:_________

(5)第(ⅲ)步主要发生的反应为歧化反应(氧化剂和还原剂为同一种物质的反应),该反应中,氧化剂和还原剂的物质的量之比为___________ 。
 是一种重要的无机功能材料,将粗
是一种重要的无机功能材料,将粗 (含较多
(含较多 和
和 杂质)样品提纯的工艺路线如下。
杂质)样品提纯的工艺路线如下。
按要求回答下列问题:
(1)本实验第(ⅰ)步需要用
 的稀
的稀 ,现采用市售浓硫酸来配制该溶液。
,现采用市售浓硫酸来配制该溶液。①配制该溶液时,除烧杯、量筒、玻璃棒外,还缺少的玻璃仪器是
②如图为市售浓硫酸试剂瓶上所贴标签的部分内容。经计算,本配制实验需要用量筒量取该浓硫酸的体积为
 。
。| 硫酸(化学纯) 分子式:  相对分子质量:98 密度:  质量分数:98% |
a.量取浓硫酸时俯视量筒的刻度线
b.定容时俯视容量瓶的度线
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时酒到容量瓶外,继续用该未清洗的容量瓶重新配制
④使用浓硫酸时,存在一定的安全风险。实验方案中出现的图标
 和
和 ,前者提示实验者结束实验后需清洗双手,后者要求实验者
,前者提示实验者结束实验后需清洗双手,后者要求实验者a.稀释浓硫酸时,应将水缓慢注入浓硫酸中,并不断搅拌
b.皮肤溅上酸液,先用大量水冲洗,再涂上3%~5%的硼酸溶液
c.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
d.少量酸滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布
(2)第(ⅰ)步加稀
 时,粗
时,粗 样品中的
样品中的(3)第一次过滤后,所得
 需要洗涤,判断其已洗涤干净的方法是
需要洗涤,判断其已洗涤干净的方法是(4)完成第(ⅱ)步相关的离子反应:

(5)第(ⅲ)步主要发生的反应为歧化反应(氧化剂和还原剂为同一种物质的反应),该反应中,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
解题方法
2 . 配制 溶液,部分实验操作如图所示:
溶液,部分实验操作如图所示:
 溶液,部分实验操作如图所示:
溶液,部分实验操作如图所示: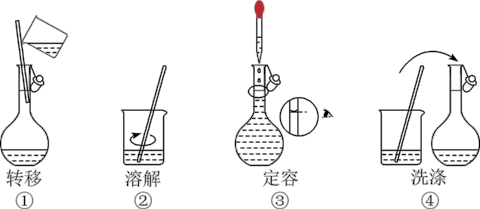
| A.实验中需要的仪器有天平、480mL容量瓶、烧杯、玻璃棒、胶头滴管等 |
| B.上述实验操作步骤的正确顺序为②①③④ |
| C.用托盘天平称量NaCl固体的质量为29.25g |
| D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低 |
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
|
解题方法
3 . 实验室欲用NaOH固体配制 的NaOH溶液,回答下列问题:
的NaOH溶液,回答下列问题:
(1)需称量氢氧化钠固体______  。
。
(2)在配制的过程中一定不需要使用到的仪器是____  填字母
填字母 ,还缺少的仪器有
,还缺少的仪器有______ 。
A.烧杯 B.药匙 C.玻璃棒 D.托盘天平 E.锥形瓶 F.胶头滴管
(3)从配制好的NaOH溶液中取出 ,OH-的物质的量浓度为
,OH-的物质的量浓度为______  ;将这
;将这 的NaOH溶液稀释至
的NaOH溶液稀释至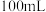 ,稀释后的溶液中
,稀释后的溶液中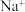 的浓度为
的浓度为 _____ 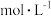 。
。
(4)下列的实验操作可能导致配制的溶液浓度偏低的是______  填字母
填字母 。
。
A.容量瓶内原来存有少量的水未进行干燥
B.称量固体时,所用砝码已生锈
C.NaOH固体溶解后,未冷却至室温就开始进行转移
D.定容时仰视视刻度线
E.定容时液面超过刻度线,用胶头滴管吸出
(5)金属铝可溶解在NaOH溶液中,写出反应的化学方程式_________________ 。
 的NaOH溶液,回答下列问题:
的NaOH溶液,回答下列问题:(1)需称量氢氧化钠固体
 。
。(2)在配制的过程中一定不需要使用到的仪器是
 填字母
填字母 ,还缺少的仪器有
,还缺少的仪器有A.烧杯 B.药匙 C.玻璃棒 D.托盘天平 E.锥形瓶 F.胶头滴管
(3)从配制好的NaOH溶液中取出
 ,OH-的物质的量浓度为
,OH-的物质的量浓度为 ;将这
;将这 的NaOH溶液稀释至
的NaOH溶液稀释至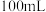 ,稀释后的溶液中
,稀释后的溶液中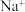 的浓度为
的浓度为 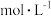 。
。(4)下列的实验操作可能导致配制的溶液浓度偏低的是
 填字母
填字母 。
。A.容量瓶内原来存有少量的水未进行干燥
B.称量固体时,所用砝码已生锈
C.NaOH固体溶解后,未冷却至室温就开始进行转移
D.定容时仰视视刻度线
E.定容时液面超过刻度线,用胶头滴管吸出
(5)金属铝可溶解在NaOH溶液中,写出反应的化学方程式
您最近一年使用:0次
解题方法
4 .  和
和 是中学化学中常见的物质,在生产生活中有重要的用途。
是中学化学中常见的物质,在生产生活中有重要的用途。
i.某小组同学依据性质差异,采用比较的方法设计实验鉴别 和
和 。
。
(1)实验Ⅰ中,分别向两支试管中滴加几滴水,A中温度计示数略有降低,B中温度计示数升高。说明固体b与水作用的过程中_______ (填“放出”或“吸收”)热量,可判断固体b为 。
。
(2)实验Ⅱ中,向试管C和D中分别加入5mL水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。判断固体d为_______ (填化学式)。
(3)25℃时,在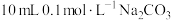 溶液中逐滴加入
溶液中逐滴加入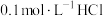 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(某微粒x的物质的量分数
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(某微粒x的物质的量分数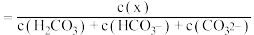
 )变化如图所示。请写出OAB段的离子方程式
)变化如图所示。请写出OAB段的离子方程式_______ 。

ii.实验室用 固体配制500 mL 0.10 mol/L的
固体配制500 mL 0.10 mol/L的 溶液,回答下列问题:
溶液,回答下列问题:
(4)称量的 固体质量应为
固体质量应为_______ g。
(5)实验操作的正确顺序是_______ 。(填序号)
①将称量好的 中加适量蒸馏水溶解在小烧杯中。
中加适量蒸馏水溶解在小烧杯中。
②将①所得溶液冷却到室温后,小心转入_______ (填仪器名称)中。
③将容量瓶瓶塞塞紧,充分摇匀。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次。
⑤继续加蒸馏水至液面距刻度线1~2cm处,改用_______ (填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
(6)取出100mL配制好的溶液,加蒸馏水稀释至 。则稀释后溶液的体积为
。则稀释后溶液的体积为_______ 。
(7)下列操作会使所配溶液的物质的量浓度偏低的是_______。(填字母序号)
 和
和 是中学化学中常见的物质,在生产生活中有重要的用途。
是中学化学中常见的物质,在生产生活中有重要的用途。i.某小组同学依据性质差异,采用比较的方法设计实验鉴别
 和
和 。
。| 实验Ⅰ | 实验Ⅱ |
 |  |
 。
。(2)实验Ⅱ中,向试管C和D中分别加入5mL水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。判断固体d为
(3)25℃时,在
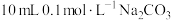 溶液中逐滴加入
溶液中逐滴加入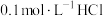 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(某微粒x的物质的量分数
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(某微粒x的物质的量分数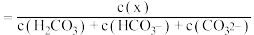
 )变化如图所示。请写出OAB段的离子方程式
)变化如图所示。请写出OAB段的离子方程式
ii.实验室用
 固体配制500 mL 0.10 mol/L的
固体配制500 mL 0.10 mol/L的 溶液,回答下列问题:
溶液,回答下列问题:(4)称量的
 固体质量应为
固体质量应为(5)实验操作的正确顺序是
①将称量好的
 中加适量蒸馏水溶解在小烧杯中。
中加适量蒸馏水溶解在小烧杯中。②将①所得溶液冷却到室温后,小心转入
③将容量瓶瓶塞塞紧,充分摇匀。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次。
⑤继续加蒸馏水至液面距刻度线1~2cm处,改用
(6)取出100mL配制好的溶液,加蒸馏水稀释至
 。则稀释后溶液的体积为
。则稀释后溶液的体积为(7)下列操作会使所配溶液的物质的量浓度偏低的是_______。(填字母序号)
| A.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 |
| B.定容时,俯视容量瓶上的刻度线 |
| C.加水定容时,水量超过了刻度线 |
| D.洗涤步骤中,洗涤液没有转入容量瓶 |
您最近一年使用:0次
名校
解题方法
5 . 葡萄糖(C6H12O6)在生物领域具有重要地位,是活细胞的能量来源和新陈代谢的中间产物,即生物的主要功能物质。纯净的葡萄糖为无色晶体,有甜味,易溶于水,微溶于乙醇,不溶于乙醚。植物可通过光合作用产生葡萄糖:6CO2+6H2O 6O2+C6H12O6。请回答下列问题:
6O2+C6H12O6。请回答下列问题:
(1)上述反应为_______ (填“氧化还原”或“非氧化还原”)反应,该反应的物质中为电解质的是_______ (写化学式)。
(2)90gC6H12O6含碳原子数目为_______ 。
(3)同温同压下,CO2和O2的密度之比为_______ 。
(4)实验室需要用90ml0.5mol/L葡萄糖溶液:
①需要用托盘天平称量葡萄糖的质量为_______ 。
②为完成此溶液配制实验,需要用到的玻璃仪器有玻璃棒、烧杯、量筒和_______ 、_______ 。
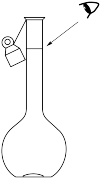
③某同学观察容量瓶液面如图所示,则所配制的溶液浓度将_______ (填“偏高”、“偏低”或“无影响”)。
 6O2+C6H12O6。请回答下列问题:
6O2+C6H12O6。请回答下列问题:(1)上述反应为
(2)90gC6H12O6含碳原子数目为
(3)同温同压下,CO2和O2的密度之比为
(4)实验室需要用90ml0.5mol/L葡萄糖溶液:
①需要用托盘天平称量葡萄糖的质量为
②为完成此溶液配制实验,需要用到的玻璃仪器有玻璃棒、烧杯、量筒和
③某同学观察容量瓶液面如图所示,则所配制的溶液浓度将

您最近一年使用:0次
2023-01-15更新
|
90次组卷
|
2卷引用:重庆市第十一中学校2022-2023学年高一上学期期末考试化学试题
名校
6 . 利用课堂上学到的知识来解决生活中的问题是我们学习的重要目的。
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸(CH3COOH)含量为0.75mol/L,则食醋中醋酸含量为_______ g/100mL,属于_______ 醋(填“酿造”或“配制”,已知:酿造醋的国家标准为醋酸含量必须大于3.50g/100mL,而配制醋仅为1.50g~3.50g/100mL)。
②乙同学将鸡蛋壳(主要成分为CaCO3)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式_______ ;在标准状况下生成的气体密度为_______ g/L(结果保留1位小数)。
(2)下图是化学实验室浓盐酸试剂标签上的部分内容。

丁同学计划用该浓盐酸配制1mol·L-1的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
①配制稀盐酸时,还缺少的仪器有_______ 。
②经计算,配制1mol·L-1的稀盐酸需要量取上述浓盐酸的体积为_______ mL(结果保留1位小数)。
③测定所配制的稀盐酸,发现其浓度大于1mol·L-1,引起误差的原因可能是_______ 。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸(CH3COOH)含量为0.75mol/L,则食醋中醋酸含量为
②乙同学将鸡蛋壳(主要成分为CaCO3)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式
(2)下图是化学实验室浓盐酸试剂标签上的部分内容。

丁同学计划用该浓盐酸配制1mol·L-1的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
①配制稀盐酸时,还缺少的仪器有
②经计算,配制1mol·L-1的稀盐酸需要量取上述浓盐酸的体积为
③测定所配制的稀盐酸,发现其浓度大于1mol·L-1,引起误差的原因可能是
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B.定容时俯视容量瓶刻度线
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
2022-04-04更新
|
760次组卷
|
4卷引用:重庆市第八中学校2021-2022学年高一上学期期末考试化学试题
重庆市第八中学校2021-2022学年高一上学期期末考试化学试题(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题
7 . 侯德榜为我国化工事业的发展贡献了毕生精力,是中国化学工业的开拓者,近代化学工业的奠基人之一,是世界制碱业的权威。
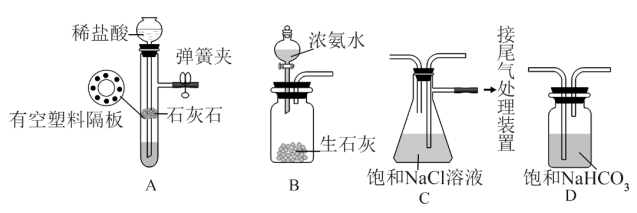
Ⅰ.侯氏制碱法的主要过程如图所示(部分物质已略去)

(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)①中发生反应的化学方程式为___________ 。
(3)根据上图,下列说法中正确的是___________ (填字母序号)。
A. 可循环使用 B.副产物
可循环使用 B.副产物 可用作肥料 C.溶液B中溶质只有NaCl
可用作肥料 C.溶液B中溶质只有NaCl
Ⅱ.某研究性学习小组感动于侯德榜先生热爱祖国、自强不息的精神,在学习了“侯氏制碱法”的原理后,决定重走科学家探索之路,进行了如下的研究:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取 的过程呢?
的过程呢?
[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置。已知浓氨水遇生石灰会产生大量的 。
。
请回答下列问题:
(4)检验装置A气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使长颈漏斗内的水面高于试管内的水面,停止加水后,若___________ ,说明装置不漏气。
(5)装置D的作用是___________ 。
(6)实验时先向饱和NaCl溶液中通入较多的 (溶液显碱性),再通入足量的
(溶液显碱性),再通入足量的 ,其原因是
,其原因是___________ (填字母序号)。
A.使 更易被吸收 B.
更易被吸收 B. 比
比 更易制取 C.
更易制取 C. 的密度比
的密度比 大
大
(7)A装置中所用的稀盐酸浓度为2mol/L,现用12mol/L浓盐酸来配制100mL该稀盐酸。
①实验室有10mL、20mL、50mL量筒,则准确配制该溶液时应最好选用___________ 量筒(填规格)量取上述浓盐酸。
②配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是___________ 。
③下面操作造成所配稀盐酸溶液浓度偏低的是___________ 。
A.容量瓶未干燥,转移溶液前有少量蒸馏水
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.定容时加水过量,从容量瓶中取出部分溶液,使液面降至刻度线
Ⅰ.侯氏制碱法的主要过程如图所示(部分物质已略去)

(1)①~③所涉及的操作方法中,包含过滤的是
(2)①中发生反应的化学方程式为
(3)根据上图,下列说法中正确的是
A.
 可循环使用 B.副产物
可循环使用 B.副产物 可用作肥料 C.溶液B中溶质只有NaCl
可用作肥料 C.溶液B中溶质只有NaClⅡ.某研究性学习小组感动于侯德榜先生热爱祖国、自强不息的精神,在学习了“侯氏制碱法”的原理后,决定重走科学家探索之路,进行了如下的研究:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取
 的过程呢?
的过程呢?[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置。已知浓氨水遇生石灰会产生大量的
 。
。
请回答下列问题:
(4)检验装置A气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使长颈漏斗内的水面高于试管内的水面,停止加水后,若
(5)装置D的作用是
(6)实验时先向饱和NaCl溶液中通入较多的
 (溶液显碱性),再通入足量的
(溶液显碱性),再通入足量的 ,其原因是
,其原因是A.使
 更易被吸收 B.
更易被吸收 B. 比
比 更易制取 C.
更易制取 C. 的密度比
的密度比 大
大(7)A装置中所用的稀盐酸浓度为2mol/L,现用12mol/L浓盐酸来配制100mL该稀盐酸。
①实验室有10mL、20mL、50mL量筒,则准确配制该溶液时应最好选用
②配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是
③下面操作造成所配稀盐酸溶液浓度偏低的是
A.容量瓶未干燥,转移溶液前有少量蒸馏水
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.定容时加水过量,从容量瓶中取出部分溶液,使液面降至刻度线
您最近一年使用:0次
8 . 阅读下列科普短文并填空:
海洋约占地球表面积的 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和 用以生产
用以生产 、
、 、
、 、
、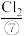 、
、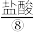 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
(1)实验室可用_______ 、_______ (填化学式)溶液检验①中的阴离子。
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式_______ ,100mL 12 mol·L-1的盐酸溶液与足量的MnO2反应实际生成的气体体积(标准状况下)_______ 6.72L(填“>”、“<”或“=”)。
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为_______ g;配制溶液所需仪器除烧杯、量筒、玻璃棒、胶头滴管外,还必须用到的一种玻璃仪器为_______ 。
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
(5)海水提溴的过程中涉及的反应有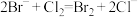 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为_______ 。潮湿的Cl2和SO2都具有漂白性,将其混合后其漂白性_______ (填“增强”、“减弱”或“无影响”)
海洋约占地球表面积的
 ,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如
,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和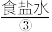 用以生产
用以生产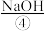 、
、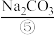 、
、 、
、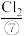 、
、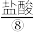 等,苦卤经过氯气氧化,热空气吹出、
等,苦卤经过氯气氧化,热空气吹出、 吸收等一系列操作可获得
吸收等一系列操作可获得 。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。
。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。(1)实验室可用
(2)实验室可用MnO2与⑧的浓溶液在加热条件下制取⑦,请写出其离子方程式
(3)实验室需要220 mL 0.1 mol·L-1 ⑤的溶液,应该用托盘天平称取Na2CO3·10H2O晶体质量为
(4)下列操作使配制的溶液物质的量浓度的偏低的是_______。
| A.定容时俯视刻度线 |
| B.转移前,容量瓶内有蒸馏水 |
| C.定容时水加多了用胶头滴管吸出 |
| D.称量是将砝码放在托盘天平的左盘(托盘天平1g以下用游码) |
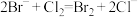 ,
, ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为
您最近一年使用:0次
名校
9 . 稀硫酸是中学实验中常用的试剂,某实验需用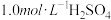 溶液480mL,可用质量分数为98%、密度为
溶液480mL,可用质量分数为98%、密度为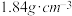 的浓硫酸配制。请回答下列问题:
的浓硫酸配制。请回答下列问题:
(1)配制稀硫酸时,需要量取________ mL浓硫酸。
(2)该实验中需用到的仪器有量筒、烧杯、玻璃棒、_______ 、________
(3)量取浓硫酸后的下一个步骤是稀释,其具体操作为________
(4)若其他操作都正确,下列情况会引起所配溶液浓度偏高的是________ (填序号)
a.用量筒量取浓硫酸时,俯视读数
b.定容时俯视容量瓶刻度线
c.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
d.稀释后未冷却至室温直接转移至容量瓶
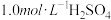 溶液480mL,可用质量分数为98%、密度为
溶液480mL,可用质量分数为98%、密度为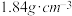 的浓硫酸配制。请回答下列问题:
的浓硫酸配制。请回答下列问题:(1)配制稀硫酸时,需要量取
(2)该实验中需用到的仪器有量筒、烧杯、玻璃棒、
(3)量取浓硫酸后的下一个步骤是稀释,其具体操作为
(4)若其他操作都正确,下列情况会引起所配溶液浓度偏高的是
a.用量筒量取浓硫酸时,俯视读数
b.定容时俯视容量瓶刻度线
c.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
d.稀释后未冷却至室温直接转移至容量瓶
您最近一年使用:0次
2019-03-03更新
|
200次组卷
|
2卷引用:重庆市第一中学校2023-2024学年高一上学期期末化学模拟试卷
名校
10 . (1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯的原理,回答下列问题:
①以上四种化学实验操作的名称依次是:______ 、______ 、______ 、_______ 。
②分离CCl4(沸点:76.75℃)和苯(沸点:110.6℃)的混合物(互溶)应选用________ ;(填装置字母)
③在使用C进行化学实验操作前,应先____________ 。
(2)实验室现需要480mL 0.10mol/L的NaOH溶液,就配制该溶液回答下列问题:
①用托盘天平称量NaOH固体___________ g。
②称量必需迅速,原因是__________________________________________ 。
③将配制好的溶液准确取出480mL后,将剩余溶液取出加水稀释至100mL保存于试剂瓶中,请给它贴上标签,标签上的内容是__________________ 。

请根据混合物分离或提纯的原理,回答下列问题:
①以上四种化学实验操作的名称依次是:
②分离CCl4(沸点:76.75℃)和苯(沸点:110.6℃)的混合物(互溶)应选用
③在使用C进行化学实验操作前,应先
(2)实验室现需要480mL 0.10mol/L的NaOH溶液,就配制该溶液回答下列问题:
①用托盘天平称量NaOH固体
②称量必需迅速,原因是
③将配制好的溶液准确取出480mL后,将剩余溶液取出加水稀释至100mL保存于试剂瓶中,请给它贴上标签,标签上的内容是
您最近一年使用:0次
2019-01-28更新
|
350次组卷
|
2卷引用:【校级联考】重庆市江津中学、合川中学等七校2018-2019学年高一上学期期末考试化学试题



