1 . 回答下列问题。
I.如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):①接___________,___________接___________,___________接___________。___________
(2)烧瓶A发生反应的离子方程式为___________ 。
(3)容器D的作用是___________ ,容器E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有___________ 溶液吸收尾气,离子方程式为___________ 。
Ⅱ.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(5)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有___________ 。
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为___________ g,要完成本实验该同学应称出___________ g NaOH。

(7)使用容量瓶前必须进行的一步操作是___________ 。
(8)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是___________ 。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
I.如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):①接___________,___________接___________,___________接___________。
(2)烧瓶A发生反应的离子方程式为
(3)容器D的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
Ⅱ.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(5)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为

(7)使用容量瓶前必须进行的一步操作是
(8)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
您最近一年使用:0次
2 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数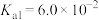 ,
,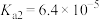 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.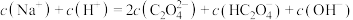
b.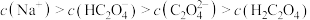
c.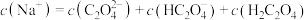
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。
①需称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②平均消耗 溶液的体积为
溶液的体积为_________ mL,样品中 的质量分数为
的质量分数为_________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数_________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数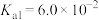 ,
,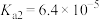 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
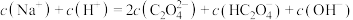
b.
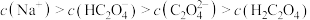
c.
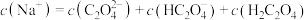
d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250mL0.10mol⋅L-1的 溶液。
溶液。①需称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤Ⅱ:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②平均消耗
 溶液的体积为
溶液的体积为 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
3 . NaClO2是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出ClO2,某探究小组制备NaClO2所需装置如图所示(夹持装置略):
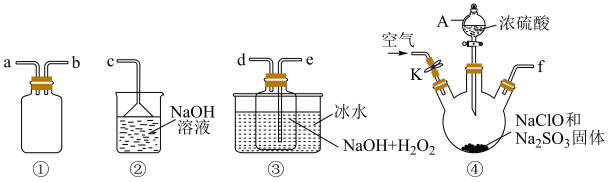
已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,
①该同学应用托盘天平称取NaOH固体___________ g。
②配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要___________ 。
③定容时仰视刻度线,则所配制的溶液的浓度会___________ (填“偏高”、“偏低”、“不变”)。
(2)仪器A的名称是___________ ,装置连接顺序为___________ (按气流方向,用小写字母表示,每个装置仅用一次)。
(3)装置④中发生反应的化学方程式为___________ 。
(4)②中NaOH溶液的作用是___________ ;打开K通入足量空气的目的是___________ 。
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的___________ 倍。

已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,
①该同学应用托盘天平称取NaOH固体
②配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要
③定容时仰视刻度线,则所配制的溶液的浓度会
(2)仪器A的名称是
(3)装置④中发生反应的化学方程式为
(4)②中NaOH溶液的作用是
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的
您最近一年使用:0次
解题方法
4 . 小明用 固体完成配置
固体完成配置 溶液的实验活动,下列有关说法正确的是
溶液的实验活动,下列有关说法正确的是
 固体完成配置
固体完成配置 溶液的实验活动,下列有关说法正确的是
溶液的实验活动,下列有关说法正确的是A.该实验方案中出现 与 与 图标 图标 |
| B.必须用到的仪器有玻璃棒、温度计、容量瓶、胶头滴管 |
| C.定容时仰视容量瓶刻度线,配置所得溶液浓度将偏低 |
| D.操作步骤为:计算→称量→溶解→定容→转移→摇匀 |
您最近一年使用:0次
解题方法
5 . 某同学配制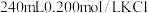 溶液,下列描述正确的是
溶液,下列描述正确的是

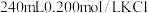 溶液,下列描述正确的是
溶液,下列描述正确的是
A.应选用 规格的容量瓶 规格的容量瓶 | B.图甲为将烧杯中热的溶液转移至容量瓶 |
| C.图乙是定容操作,胶头滴管应伸入容量瓶内 | D.定容时俯视刻度线,所配制溶液浓度偏低 |
您最近一年使用:0次
名校
6 . I.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂;某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气;并模拟工业制漂白粉。请回答下列问题:

(1)图中制氯气的化学方程式___________ 。
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用);仪器连接顺序为(用仪器下方字母表示:如A→B→…)___________ 。
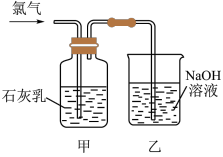
(3)氯气可以杀菌消毒的原因是(请用化学方程式结合文字表述)___________ 。
II.漂白粉的制备
(4)写出制取漂白粉的化学方程式并用双线桥表示电子的转移___________ 。乙装置的作用是___________ 。漂白粉露置在空气中会失效,涉及到的反应是___________ 、___________ 。
(5)本实验使用的浓盐酸试剂瓶标签上的有关数据如下图。
①该浓盐酸中HCl的物质的量浓度为___________ 。
②若用该浓盐酸和蒸馏水配制500mL0.400mol/L的稀盐酸,需要量取___________ mL上述浓盐酸进行配制。
③若量取浓盐酸时俯视刻度线,则所配溶液浓度___________ (填“偏高”或“偏低”)。

(1)图中制氯气的化学方程式
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用);仪器连接顺序为(用仪器下方字母表示:如A→B→…)

(3)氯气可以杀菌消毒的原因是(请用化学方程式结合文字表述)
II.漂白粉的制备
(4)写出制取漂白粉的化学方程式并用双线桥表示电子的转移
(5)本实验使用的浓盐酸试剂瓶标签上的有关数据如下图。
| 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% 体积:500nL |
②若用该浓盐酸和蒸馏水配制500mL0.400mol/L的稀盐酸,需要量取
③若量取浓盐酸时俯视刻度线,则所配溶液浓度
您最近一年使用:0次
名校
解题方法
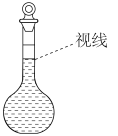
7 . 现需要 溶液,用胆矾晶体进行配制。下列有关说法正确的是
溶液,用胆矾晶体进行配制。下列有关说法正确的是
 溶液,用胆矾晶体进行配制。下列有关说法正确的是
溶液,用胆矾晶体进行配制。下列有关说法正确的是
| A.配制时,实际选用的容量瓶规格为470 mL | B.配制时,容量瓶洗净后需干燥后才能使用 |
| C.定容时,如图操作会导致所配溶液浓度偏高 | D.摇匀后,需再加水使容量瓶凹液面达到刻度线 |
您最近一年使用:0次
2023-04-22更新
|
201次组卷
|
3卷引用:四川省泸州市2022-2023学年高一上学期期末考试化学试题
8 . 小组同学探究 的性质及工业制法。
的性质及工业制法。
(1)用 固体配制
固体配制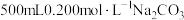 溶液。
溶液。
i.用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、___________ 。
ii.计算需要 固体的质量是
固体的质量是___________ g。
iii.下列主要操作步骤的正确顺序是___________ (填字母)。
a.称取一定质量的碳酸钠固体,放入烧杯中,加入适量蒸馏水溶解;
b.向容量瓶中加水至液面离容量瓶刻度线下1-2cm,改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
c.将溶液转移到500mL容量瓶中;
d.盖好瓶塞,反复翻转,摇匀;
e.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
iv.下列情况中,会使所配溶液浓度偏高的是___________ (填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)探究 与盐酸的反应。向
与盐酸的反应。向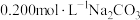 溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:
溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为: 、
、___________ 。
(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。通过“联合制碱法”得到的纯碱产品中往往含少量 ,为测定产品中
,为测定产品中 的质量分数,进行如下操作:
的质量分数,进行如下操作:
①称取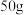 样品放入烧杯内加水溶解。
样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,经过滤、___________ 等操作,称量沉淀的质量为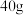 。则样品中
。则样品中 的质量分数为
的质量分数为___________ 。
 的性质及工业制法。
的性质及工业制法。(1)用
 固体配制
固体配制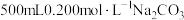 溶液。
溶液。i.用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管、
ii.计算需要
 固体的质量是
固体的质量是iii.下列主要操作步骤的正确顺序是
a.称取一定质量的碳酸钠固体,放入烧杯中,加入适量蒸馏水溶解;
b.向容量瓶中加水至液面离容量瓶刻度线下1-2cm,改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
c.将溶液转移到500mL容量瓶中;
d.盖好瓶塞,反复翻转,摇匀;
e.用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
iv.下列情况中,会使所配溶液浓度偏高的是
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)探究
 与盐酸的反应。向
与盐酸的反应。向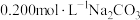 溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:
溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为: 、
、(3)我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。通过“联合制碱法”得到的纯碱产品中往往含少量
 ,为测定产品中
,为测定产品中 的质量分数,进行如下操作:
的质量分数,进行如下操作:①称取
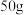 样品放入烧杯内加水溶解。
样品放入烧杯内加水溶解。②加入过量的氯化钙溶液充分反应,经过滤、
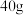 。则样品中
。则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . 配制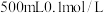 的
的 溶液,相关说法正确的是
溶液,相关说法正确的是

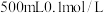 的
的 溶液,相关说法正确的是
溶液,相关说法正确的是
| A.图①:将NaOH固体直接放在托盘天平上称取 |
| B.图②:溶解后的溶液立即转移至容量瓶 |
| C.图③:需要将烧杯和玻璃棒的洗涤液一并转移至容量瓶中 |
| D.图④:定容时若俯视观察,所配溶液浓度偏低 |
您最近一年使用:0次
名校
10 . Ⅰ.下表是某儿童在哈尔滨市医疗机构临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童_______ 元素含量偏低(填元素名称)。
(2)报告单中“mol·L-1”是_______ (填“质量”、“体积”或“浓度”)的单位。
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是_______ ?(计算结果保留两位小数)
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
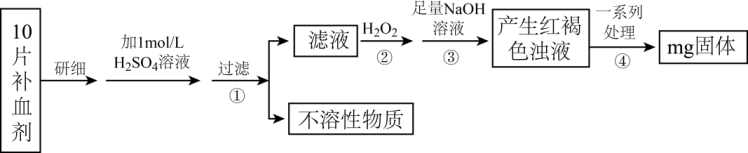
请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_______ (填离子符号)。
(5)步骤②加入过量H2O2的目的是_______ 。步骤②反应的离子方程式为_______
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______ g。服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的_______ 。(填“氧化性”或“还原性”)。
(7)由FeSO4·7H2O配制450mL1mol/L FeSO4溶液,需要的玻璃仪器有玻璃棒、_______
(8)以下操作会导致所配溶液浓度偏低的是_______ 。(填序号)
A.称取敞放空气中的FeSO4·7H2O
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是_______
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | Zn | 115.92 | mol·L-l | 66-120 |
| 2 | Fe | 6.95 | mmol·L-1 | 7.52-11.82 |
| 3 | Ca | 1.78 | mmol·L-1 | 1.55-2.10 |
(1)该儿童
(2)报告单中“mol·L-1”是
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(5)步骤②加入过量H2O2的目的是
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
(7)由FeSO4·7H2O配制450mL1mol/L FeSO4溶液,需要的玻璃仪器有玻璃棒、
(8)以下操作会导致所配溶液浓度偏低的是
A.称取敞放空气中的FeSO4·7H2O
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是
您最近一年使用:0次
2023-02-02更新
|
267次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高一上学期期末复习化学试题



