名校
解题方法
1 . 下图是某同学用500mL容量瓶配制 NaOH溶液的过程:
NaOH溶液的过程:
 NaOH溶液的过程:
NaOH溶液的过程:
| A.如图所示,用托盘直接称量2.0g烧碱 |
| B.配制的正确顺序为①④③⑤②⑥ |
| C.②中定容时仰视刻线会导致溶液浓度偏高 |
| D.能用容量瓶贮存配制好的溶液 |
您最近一年使用:0次
2022-07-07更新
|
2443次组卷
|
16卷引用:四川省成都市2021-2022学年高二下学期摸底考试化学试题
四川省成都市2021-2022学年高二下学期摸底考试化学试题山东省淄博市临淄中学2022-2023学年高一上学期期末考试化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题陕西省宝鸡市渭滨区2022-2023学年高一年级上学期期末考试化学试题内蒙古巴彦淖尔市第一中学2022-2023学年高一上学期1月期末考试化学试题(已下线)第13讲 物质的量浓度-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )河南省宋基信阳实验中学2022-2023学年高三上学期9月月考化学试题(已下线)海水中的重要元素—钠和氯——课时7物质的量浓度天津市天津中学2022-2023学年高一上学期期中考试化学试题内蒙古乌兰浩特第一中学2022-2023学年高一上学期第三次月考化学试题广东省揭阳市惠来县第一中学2022-2023学年高一下学期第一次月考化学试题四川省成都经济技术开发区实验中学校2022-2023学年高二下学期5月月考化学试题福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题福建省厦门第一中学2023-2024学年高一上学期第二次月考化学试卷云南师范大学附属中学2023-2024学年高一下学期第一次月考化学试题福建省厦门大学附属实验中学2023—2024学年高一上学期第二次月考化学试卷
名校
解题方法
2 . 下列说法中正确的是
A.将标况下VL A气体(相对分子质量为M)溶于0.1L水中,所得溶液密度为 ,则此溶液的物质的量浓度为 ,则此溶液的物质的量浓度为 |
B.将 的硫酸与水等质量混合后,所得硫酸的物质的量浓度小于 的硫酸与水等质量混合后,所得硫酸的物质的量浓度小于 |
C.1mol氧气在放电条件下有30%转化为 ,则放电后的混合气体对 ,则放电后的混合气体对 的相对密度是35.6 的相对密度是35.6 |
D.配制460mL 的 的 溶液,需用量筒量取质量分数为98%,密度为 溶液,需用量筒量取质量分数为98%,密度为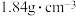 的浓硫酸5.0mL 的浓硫酸5.0mL |
您最近一年使用:0次
2023-01-04更新
|
932次组卷
|
5卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
解答题-实验探究题
|
较易(0.85)
|
名校
解题方法
3 . 要配制480mL 0.2mol·L-1的FeSO4溶液,配制过程中有如下操作步骤:
①把称量好的绿矾(FeSO4·7H2O)放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入___________ 中;
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用___________ 滴加蒸馏水至液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒,摇匀; ⑥待溶液恢复到室温。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)___________ ,完成此配制实验,除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有___________ 。
(2)实验室用绿矾(FeSO4·7H2O)来配制该溶液,用托盘天平称量绿矾___________ g。
(3)由于错误操作,使得实际浓度比所要求的偏小的是___________ (填写编号)。
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是___________
①把称量好的绿矾(FeSO4·7H2O)放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入
③继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒,摇匀; ⑥待溶液恢复到室温。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号)
(2)实验室用绿矾(FeSO4·7H2O)来配制该溶液,用托盘天平称量绿矾
(3)由于错误操作,使得实际浓度比所要求的偏小的是
A.称量绿矾时,左码右物
B.使用容量瓶配制溶液时,俯视液面定容,
C.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有干燥
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
(4)定容时,若加蒸馏水时不慎超过刻度线,处理方法是
您最近一年使用:0次
2021-07-28更新
|
1653次组卷
|
8卷引用:河南省潢川第一中学2022-2023学年高一上学期期末考试化学试题
河南省潢川第一中学2022-2023学年高一上学期期末考试化学试题内蒙古杭锦后旗奋斗中学2020-2021学年高一上学期期中考试化学试题(已下线)专题2.3.4 配制一定物质的量浓度的溶液(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)2.3.3 物质的量浓度-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)必考点10 以物质的量为中心的化学计算-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)第二章 海水中的重要元素——钠和氯(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)江苏省扬州中学2022-2023学年高一上学期期中检测化学试题河北省唐县第一中学2023-2024学年高一上学期开学考试化学试题
名校
解题方法
4 . 完成下列填空
(1)0.5molH2O的质量是___________ ,含有约___________ 个水分子。
(2)在标准状况下,4.48L的HCl物质的量为___________ ,若将其溶于水配成500mL的溶液,其物质的量浓度为___________ 。
(3)如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制100mL1.84mol/L的稀硫酸。可供选用的仪器有:胶头滴管;烧瓶;烧杯;药匙;量筒;托盘天平。
请回答下列问题:
①配制稀硫酸时,还缺少的仪器是___________ (填写名称)。
②经计算,配制100mL1.84mol·L-1的稀硫酸需要量取上述浓硫酸的体积为___________ mL。
③若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为___________ 。(填写字母)
A.立即用较多的水冲洗,再涂抹3%~5%的NaHCO3溶液
B.立即用NaOH溶液中和,再用大量水冲洗
④对所配制的稀硫酸进行测定,发现其浓度大于1.84mol·L-1,配制过程中下列各项操作可能引起该误差的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将硫酸稀释后立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(1)0.5molH2O的质量是
(2)在标准状况下,4.48L的HCl物质的量为
(3)如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制100mL1.84mol/L的稀硫酸。可供选用的仪器有:胶头滴管;烧瓶;烧杯;药匙;量筒;托盘天平。
硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
①配制稀硫酸时,还缺少的仪器是
②经计算,配制100mL1.84mol·L-1的稀硫酸需要量取上述浓硫酸的体积为
③若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为
A.立即用较多的水冲洗,再涂抹3%~5%的NaHCO3溶液
B.立即用NaOH溶液中和,再用大量水冲洗
④对所配制的稀硫酸进行测定,发现其浓度大于1.84mol·L-1,配制过程中下列各项操作可能引起该误差的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将硫酸稀释后立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
您最近一年使用:0次
2022-01-01更新
|
811次组卷
|
3卷引用:北京市人民大学附属中学2021-2022学年高一上学期期末考试化学试题
名校
5 . 实验室需配制480mL0.1mol•L-1NaOH溶液,下列说法正确的是
| A.应用烧杯盛放,在托盘天平上称取NaOH固体2.0g |
| B.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、480mL容量瓶 |
| C.为防止在空气中吸收CO2,溶解NaOH后迅速将溶液转移至容量瓶中 |
| D.定容时仰视会造成所配制溶液的物质的量浓度偏大 |
您最近一年使用:0次
2023-09-15更新
|
469次组卷
|
3卷引用:山东省枣庄市第八中学2022-2023学年高一上学期期末考试化学试题
山东省枣庄市第八中学2022-2023学年高一上学期期末考试化学试题江苏省江都区大桥中学2023-2024学年高一上学期期末复习模拟测试化学试题(已下线)【精品卷】2.3.3 物质的量浓度课堂例题-人教版2023-2024学年必修第一册
名校
6 . 一场突如其来的新冠肺炎疫情,给人们的生活带来了巨大的冲击,在疫情期间外出需戴好口罩,返家后立即杀菌消毒。双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO25%,密度为1.19 g/cm3的消毒液。下列说法正确的有______________________ 。
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为140 g
E.定容时俯视刻度线,会使配制溶液浓度偏低
F.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
(2)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是_________ 。(填序号)
(3)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性: NaClO______________________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为_________ mol。
II.二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂
(4)KClO3和浓盐酸在一定温度下反应会生成 ClO2和Cl2,该反应的离子方程式________ 。
(5)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式____________ 。
(1)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO25%,密度为1.19 g/cm3的消毒液。下列说法正确的有
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为140 g
E.定容时俯视刻度线,会使配制溶液浓度偏低
F.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
(2)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
序号 | 实验 | 实验现象 |
1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
II.二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂
(4)KClO3和浓盐酸在一定温度下反应会生成 ClO2和Cl2,该反应的离子方程式
(5)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的化学方程式
您最近一年使用:0次
名校
7 . 新冠病毒疫情期间,含氯消毒剂得到了广泛应用。某“84”消毒液部分标签如图所示,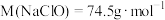 ,请回答下列问题:
,请回答下列问题:
(1)计算该“84”消毒液的物质的量浓度为___________  (保留小数点后一位);
(保留小数点后一位);
(2)现需用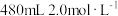 的
的 的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要
的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要___________ ;
(3)下列情况会使所配溶液浓度偏低的是___________ (填序号);
①溶液未经冷却即转移至容量瓶并定容
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线
⑤定容时,仰视容量瓶的刻度线
(4)含氯消毒剂的消毒能力可以用“有效氯”来表示,“有效氯”是指与含氯消毒剂氧化能力相当的氯气的质量。某溶液中含有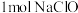 ,该溶液的“有效氯”是
,该溶液的“有效氯”是___________ g。
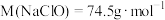 ,请回答下列问题:
,请回答下列问题:【有效成分】 | 【质量分数】24% |
【密度】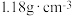 | 【净含量】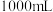 |
| 【注意事项】…… | |
 (保留小数点后一位);
(保留小数点后一位);(2)现需用
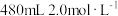 的
的 的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要
的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要(3)下列情况会使所配溶液浓度偏低的是
①溶液未经冷却即转移至容量瓶并定容
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线
⑤定容时,仰视容量瓶的刻度线
(4)含氯消毒剂的消毒能力可以用“有效氯”来表示,“有效氯”是指与含氯消毒剂氧化能力相当的氯气的质量。某溶液中含有
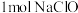 ,该溶液的“有效氯”是
,该溶液的“有效氯”是
您最近一年使用:0次
2022-01-25更新
|
562次组卷
|
4卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题浙江省湖州市安吉县高级中学等2021-2022学年高一下学期返校联考化学试题(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
8 . 回答下列问题
(1)实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体___________ g;完成本实验需用到的仪器有天平、药匙、玻璃棒、烧杯和___________ ;下列情况会使所配溶液浓度偏低的是___________ (填序号)。
①用天平称量质量时,被称量物与砝码的位置放颠倒了
②转移溶液前容量瓶内有少量蒸馏水
③定容时俯视刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(2)某混合溶液中,含有K+、Mg2+、Al3+、Cl-和SO 五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO
五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO 的物质的量浓度是
的物质的量浓度是___________ 。
(3)同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则该气体的相对分子质量为___________ 。
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,则X2的相对分子质量为___________ 。
(5)若标准状况下气体X2的密度为1.25 g·L-1,X原子最外层有___________ 个电子。
(1)实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,需称取Na2CO3·10H2O晶体
①用天平称量质量时,被称量物与砝码的位置放颠倒了
②转移溶液前容量瓶内有少量蒸馏水
③定容时俯视刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(2)某混合溶液中,含有K+、Mg2+、Al3+、Cl-和SO
 五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO
五种离子(不考虑溶液中少量H+和OH-),其中c(K+)=3 mol/L、c(Mg2+)=2 mol/L、c(Al3+)=2 mol/L、c(Cl-)=7 mol/L,则溶液中SO 的物质的量浓度是
的物质的量浓度是(3)同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则该气体的相对分子质量为
(4)相同状况下,若气体X2与氮气以体积比1∶4混合,该混合气体相对氢气的密度为14.4,则X2的相对分子质量为
(5)若标准状况下气体X2的密度为1.25 g·L-1,X原子最外层有
您最近一年使用:0次
2023-05-04更新
|
391次组卷
|
2卷引用:陕西省西安市长安区第一中学2022-2023学年高一上学期期末考试化学试题
名校
9 . 某学习小组为认识铁及其化合物的性质和分散系的性质做了如下一系列综合实验。运用所学知识,回答下列问题:
(1)可利用___________ 来区分 胶体和
胶体和 溶液。
溶液。
(2)向盛有 溶液的试管中滴加
溶液的试管中滴加 溶液,请描述发生的现象
溶液,请描述发生的现象___________ 。
(3)铁粉与水蒸气在高温条件下反应的化学方程式是___________ 。
(4)电子工业中,人们常用 溶液腐蚀覆铜板来制作印刷电路板。现欲配制
溶液腐蚀覆铜板来制作印刷电路板。现欲配制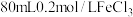 溶液,回答下列问题:
溶液,回答下列问题:
①配制该溶液时所需玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还需___________ 。
②使用托盘天平称量 的质量为
的质量为___________ g。
③定容时,若仰视容量瓶刻度线会使配制的 溶液浓度
溶液浓度________ (填“偏大”“偏小”或“不变”)。
(5)实验室模拟用 溶液腐蚀铜板并从废液中回收
溶液腐蚀铜板并从废液中回收 和
和 溶液流程如图所示:
溶液流程如图所示:
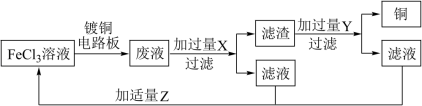
①请写出 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式___________ 。
②试剂 在反应中体现
在反应中体现___________ (填“氧化性”或“还原性”)。
③Z可选用的试剂有___________ (填序号)。
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
(1)可利用
 胶体和
胶体和 溶液。
溶液。(2)向盛有
 溶液的试管中滴加
溶液的试管中滴加 溶液,请描述发生的现象
溶液,请描述发生的现象(3)铁粉与水蒸气在高温条件下反应的化学方程式是
(4)电子工业中,人们常用
 溶液腐蚀覆铜板来制作印刷电路板。现欲配制
溶液腐蚀覆铜板来制作印刷电路板。现欲配制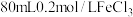 溶液,回答下列问题:
溶液,回答下列问题:①配制该溶液时所需玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外,还需
②使用托盘天平称量
 的质量为
的质量为③定容时,若仰视容量瓶刻度线会使配制的
 溶液浓度
溶液浓度(5)实验室模拟用
 溶液腐蚀铜板并从废液中回收
溶液腐蚀铜板并从废液中回收 和
和 溶液流程如图所示:
溶液流程如图所示:
①请写出
 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式②试剂
 在反应中体现
在反应中体现③Z可选用的试剂有
A.硝酸 B.酸性高锰酸钾溶液 C.过氧化氢 D.氯气
您最近一年使用:0次
2023-08-03更新
|
363次组卷
|
5卷引用:湖南省株洲市南方中学2022-2023学年高一上学期期末考试化学试题
湖南省株洲市南方中学2022-2023学年高一上学期期末考试化学试题湖南省娄底市新化县2023-2024学年高一上学期期末考试化学试题(已下线)巩固测试卷02-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)甘肃省天水市第一中学2023-2024学年高一下学期开学化学试题山东省滨州市惠民县第二中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
10 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。

回答下列问题:
(1)已知D可用于实验室制 ,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是
,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为_______ 。
(3)取 某84消毒液(有效成分
某84消毒液(有效成分 含量为
含量为 ),加水稀释,配制成
),加水稀释,配制成 稀溶液。
稀溶液。
①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、_______ 。
②关于配制过程的下列说法中,正确的是_______ (填字母)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C.定容时,俯视观察刻度线可能导致结果偏低
D.定容摇匀后,将溶液保存于容量瓶中,随用随取
③稀释后的溶液中, 的物质的量浓度为
的物质的量浓度为_______  。
。
(4)工业上“侯氏制碱法”以 、
、 、
、 及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:

①实验室分离出沉淀的操作名称是_______ ;煅烧炉里进行的化学反应方程式为:_______ 。
②检验产品 中是否含有氯离子,需要的试剂有
中是否含有氯离子,需要的试剂有_______ 。

回答下列问题:
(1)已知D可用于实验室制
 ,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是
,焰色试验时其火焰呈现紫色。A、B、C、D四种物质中,属于电解质的是(2)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为
(3)取
 某84消毒液(有效成分
某84消毒液(有效成分 含量为
含量为 ),加水稀释,配制成
),加水稀释,配制成 稀溶液。
稀溶液。①配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②关于配制过程的下列说法中,正确的是
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C.定容时,俯视观察刻度线可能导致结果偏低
D.定容摇匀后,将溶液保存于容量瓶中,随用随取
③稀释后的溶液中,
 的物质的量浓度为
的物质的量浓度为 。
。(4)工业上“侯氏制碱法”以
 、
、 、
、 及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
及水等为原料制备纯碱,生产纯碱的工艺流程示意图如下:
①实验室分离出沉淀的操作名称是
②检验产品
 中是否含有氯离子,需要的试剂有
中是否含有氯离子,需要的试剂有
您最近一年使用:0次
2023-01-01更新
|
567次组卷
|
3卷引用:辽宁省大连市2022-2023学年高一上学期期末考试化学试题



