1 . 关于下列实验操作、现象和相应结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用CCl4萃取碘水后,先从下口放出下层溶液,再向另一个烧杯中从下口放出上层液体 | 下层溶液为紫色,上层为无色 | CCl4的密度比水大且碘在CCl4中溶解度比在水中的大 |
| B | 向过氧化钠样品中滴加过量的盐酸,将生成的气体通入CaCl2溶液 | 无白色沉淀产生 | 样品未变质 |
| C | 鉴别碳酸钠、碳酸氢钠溶液,向装有两溶液的两支试管中滴加氢氧化钡溶液 | 一支试管无明显现象,一支试管中产生白色沉淀 | 产生白色沉淀的溶液是碳酸钠 |
| D | 向NaBr溶液中加入少量苯,通入适量Cl2后,充分振荡、静置 | 有机层变为橙红色 | Cl2的氧化性强于Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列实验方案中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 除去 中混有的 中混有的 | 将气体通入饱和 溶液中洗气 溶液中洗气 |
| B | 检验绿矾晶体是否已变质 | 将绿矾样品溶于稀 后,滴加 后,滴加 溶液,观察溶液是否变红 溶液,观察溶液是否变红 |
| C | 检验 在 在 溶液中是否发生水解 溶液中是否发生水解 | 将 与 与 溶液共热,冷却后,取出上层水溶液,加入 溶液共热,冷却后,取出上层水溶液,加入 溶液,观察是否产生白色沉淀 溶液,观察是否产生白色沉淀 |
| D | 从碘水中提取 | 将碘水与苯混合充分振荡、静置后,下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,继续从分液漏斗下端管口放出上层液体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列说法正确的是 ( )
| A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质 |
| B.去除粗食盐水中Ca2+、SO42-等杂质,应先加Na2CO3溶液,后加BaCl2溶液 |
| C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出 |
| D.用BaCl2溶液和稀盐酸来检验Na2CO3样品是否含有SO42-杂质 |
您最近一年使用:0次
名校
4 . 由下列实验及现象,推出的相应结论正确的是( )
| 实验 | 现象 | 结论 |
| A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
| B.①取少量绿矾样品,加水溶解, 滴加 KSCN 溶液 ②向溶液中通入空气 | ①溶液颜色无变化 ②溶液逐渐变红 | ①绿矾样品未变质 ②Fe2+易被空气氧化为 Fe3+ |
| C.①某溶液中加入 Ba(NO3)2 溶 液 ②再加入足量盐酸 | ①产生白色沉淀 ②仍有白色沉淀 | 原溶液中有 SO42﹣ |
| D.向碘水中加入等体积 CCl4, 振荡后静置 | 上层接近无色,下层显紫红色 | I2 在 CCl4 中的溶解度小于在水中 的溶解度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-26更新
|
234次组卷
|
3卷引用:【全国百强校】山西省太原市第五中学2018-2019学年高一上学期12月月考化学试题
5 . 下列说法正确的是
| A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质 |
| B.食盐水中Ca2+、SO42-等杂质的去除,应先加Na2CO3溶液,后加BaCl2溶液 |
| C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出 |
| D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质 |
您最近一年使用:0次
2016-12-09更新
|
356次组卷
|
4卷引用:2015-2016学年江苏省宿迁市高一上学期期末考试化学试卷
6 . 某化学小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁(Fe2O3),并进行铁含量的测定。主要操作步骤如下:
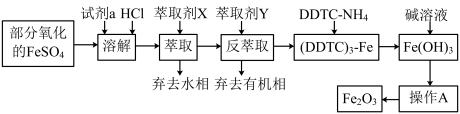
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH 。
。
请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式_________ 。
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的___ 放气;为提高萃取率和产品产量,实验时应进行的操作是__________ 。
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)____ 。
(4)操作A为_____ 、_____ 、______ 。产品处理时,温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图所示,则温度最好控制在______ ℃。

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用______ (填仪器名称)移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定,消耗K2Cr2O7溶液20.60mL。产品中铁的含量为______ (假设杂质不与K2Cr2O7反应)。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH
 。
。请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)
(4)操作A为

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用
您最近一年使用:0次
2020-07-28更新
|
390次组卷
|
6卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
解题方法
7 . 某化学兴趣小组在实验室从海带灰中提取碘并制备KI晶体。请回答下列问题
(1)从水溶液中萃取碘可以选用的试剂是____________ 。(填序号)
A.酒精 B.CCl4 C.己烯 D.直馏汽油
(2)KI晶体的制备,实验装置如图:
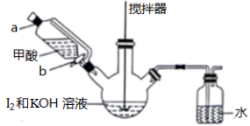
实验步骤如下
i.配制0.5mol·L−1的KOH溶液。
i.在三颈瓶中加入12.7g单质I2和250mL 0.5mol·L−1的KOH溶液,搅拌至碘完全溶解。
ⅲ.通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后,HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品8.3g。请回答下列问题:
①配制0.5mol·L−1 KOH溶液时,下列操作导致配得的溶液浓度偏高的是_____ (填序号)。
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
②步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1∶5,请写出氧化产物的化学式:____________ 。
③步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞___________ 。(填“a”“b”或“a和b”)
④实验中,加入HCOOH发生氧化还原反应的离子方程式为____________________ 。
⑤实验中KI的产率为________________ %
(1)从水溶液中萃取碘可以选用的试剂是
A.酒精 B.CCl4 C.己烯 D.直馏汽油
(2)KI晶体的制备,实验装置如图:

实验步骤如下
i.配制0.5mol·L−1的KOH溶液。
i.在三颈瓶中加入12.7g单质I2和250mL 0.5mol·L−1的KOH溶液,搅拌至碘完全溶解。
ⅲ.通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后,HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品8.3g。请回答下列问题:
①配制0.5mol·L−1 KOH溶液时,下列操作导致配得的溶液浓度偏高的是
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
②步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1∶5,请写出氧化产物的化学式:
③步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞
④实验中,加入HCOOH发生氧化还原反应的离子方程式为
⑤实验中KI的产率为
您最近一年使用:0次



