1 . 历经十年传承积淀,形成精湛的东阿阿胶传统工艺,包括洗皮、泡皮、晾皮、刮毛、铡皮、化皮、打沫、除渣、浓缩、挂旗、凝胶、切胶等工序。下列工序与化学实验中的原理不具有对应关系的是
| 选项 | A | B | C | D |
| 工序 |
|
|
|
|
| 化学实验 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022高二·广东·学业考试
解题方法
2 . 检验芹菜中铁元素的实验操作有:①剪碎芹菜,研磨;②取少量滤液,滴加稀 ;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为
;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为
 ;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为
;③加入蒸馏水,搅拌,过滤;④滴加几滴KSCN溶液,振荡,观察。正确操作顺序为| A.③①④② | B.①②③④ | C.②①④③ | D.①③②④ |
您最近一年使用:0次
2023-06-02更新
|
281次组卷
|
4卷引用:专题二 物质的检验、除杂和鉴别
3 . 磷酸亚铁锂(LiFePO4)是新型锂离子电池的电极材料,其制备流程如下:

不同温度下碳酸锂的溶解度如下表所示:
(1)已知,锂与镁在元素周期表中位于对角线位置,写出碳酸锂高温煅烧分解的化学方程式___________ 。
(2)①操作1需要使用过滤装置,下图是过滤操作示意图,其操作不规范的是___________ (填标号)。
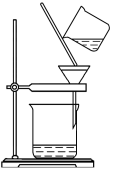
a.漏斗末端颈尖未紧靠烧杯内壁
b.过滤时利用玻璃棒引流
c.将滤纸湿润,使其紧贴漏斗壁
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②煅烧时,需要使用下列仪器中的___________ (填仪器名称)。
(3)研磨的目的是___________ (任答一点)。
(4)“沉锂”需要在95℃以上进行,主要原因是___________ 。过滤碳酸锂所得母液中主要含有硫酸钠,可能还含有___________ 和___________ 。
(5)制备磷酸亚铁锂的过程必须在惰性气体氛围中进行,原因是___________ 。
(6)在“煅烧”操作中,除了生成磷酸亚铁锂和乙酸外,还有其他气体产物逸出,写出该反应的化学方程式___________ 。

不同温度下碳酸锂的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/ (g·L-1) | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)①操作1需要使用过滤装置,下图是过滤操作示意图,其操作不规范的是

a.漏斗末端颈尖未紧靠烧杯内壁
b.过滤时利用玻璃棒引流
c.将滤纸湿润,使其紧贴漏斗壁
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
②煅烧时,需要使用下列仪器中的

(3)研磨的目的是
(4)“沉锂”需要在95℃以上进行,主要原因是
(5)制备磷酸亚铁锂的过程必须在惰性气体氛围中进行,原因是
(6)在“煅烧”操作中,除了生成磷酸亚铁锂和乙酸外,还有其他气体产物逸出,写出该反应的化学方程式
您最近一年使用:0次
2023·浙江绍兴·模拟预测
4 . 硫代硫酸钠(Na2S2O3∙5H2O)俗称大苏打,主要用作照相业定影剂。实验室中用工业硫化钠、纯碱、二氧化硫等物质制备硫代硫酸钠晶体的流程如下:

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


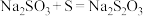
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和___________ ;回流适用的加热方式是___________ 。
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是___________ 。
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:
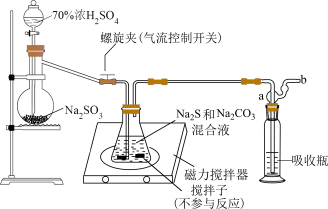
①锥形瓶中发生总反应的化学方程式为___________ ;反应中Na2CO3固体的用量不宜过少,理由是___________ 。
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是___________ 。
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:________
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


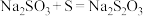
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:

①锥形瓶中发生总反应的化学方程式为
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出
您最近一年使用:0次
2023·浙江金华·模拟预测
解题方法
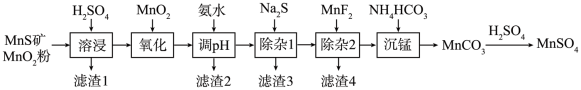
5 . 高纯硫酸锰作为合成镍钴锰三元聚合物锂电池的正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下图所示:
相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答:
(1)“溶浸”步骤中,可加快溶浸速率的措施有___________ (写两条)。
(2)下列有关该工艺流程的叙述正确的是___________。
(3)“除杂2”步骤的目的是生成MgF2沉淀从而除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,请从平衡移动的角度解释其原因___________ 。
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。______
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
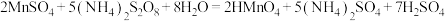
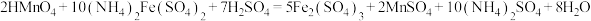 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
用___________ 称量 MnSO4样品0.250g→用100mL容量瓶将MnSO4样品配成100mL溶液→用___________ 取待测液25.00mL于锥形瓶中→加入适量硫磷混合酸和硝酸银,再加入足量过硫酸铵充分反应→加热煮沸除去多余的过硫酸铵→用酸式滴定管盛装0.1000mol/L(NH4)2Fe(SO4)2标准溶液,滴定3次,分别消耗20.04mL、19.30mL、19.96mL。
②根据以上数据计算样品中MnSO4的质量分数___________ 。

相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”步骤中,可加快溶浸速率的措施有
(2)下列有关该工艺流程的叙述正确的是___________。
| A.“溶浸”步骤中的“滤渣1”的主要成分是S和SiO2(或不溶性硅酸盐) |
| B.“氧化”步骤中添加的MnO2的作用是催化剂 |
| C.“调pH”步骤中,溶液的pH范围应调节为4.7~6 |
D.“沉锰”步骤的离子方程式为 |
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
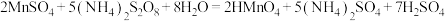
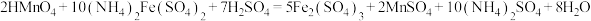 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:用
②根据以上数据计算样品中MnSO4的质量分数
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
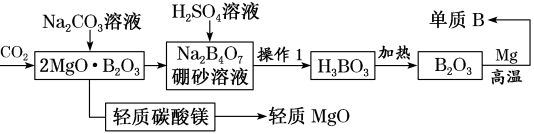
6 . 工业利用硼矿石(2MgO·B2O3)制备单质B并联产轻质MgO的流程如图:
硼酸(H3BO3)的溶解度
操作1是_____ ,整个流程中可循环利用的物质是_____ 。

硼酸(H3BO3)的溶解度
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 80 |
| 溶解度/g | 2.77 | 3.65 | 4.87 | 6.77 | 8.90 | 23.54 |
操作1是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
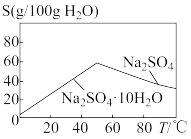
7 . 下图是Na2SO4和Na2SO4·10H2O的溶解度曲线,则由Na2SO4溶液得到Na2SO4固体的操作是___________ →___________ →用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是___________ 。

您最近一年使用:0次
8 . 某研究所研发出一种利用MnOOH催化谷胱甘肽自氧化产生活性氧的方法。某小组以菱锰矿(主要成分为 ,含少量Fe、Al、Si、Co的氧化物)为原料制备高纯度MnOOH,流程如图所示:
,含少量Fe、Al、Si、Co的氧化物)为原料制备高纯度MnOOH,流程如图所示:
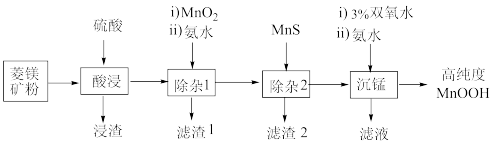
已知:①MnOOH难溶于水和碱性溶液。
②几种金属离子沉淀的pH如表所示:
下列叙述错误的是
 ,含少量Fe、Al、Si、Co的氧化物)为原料制备高纯度MnOOH,流程如图所示:
,含少量Fe、Al、Si、Co的氧化物)为原料制备高纯度MnOOH,流程如图所示:
已知:①MnOOH难溶于水和碱性溶液。
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  | 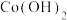 |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
A.“浸渣”主要成分是 |
| B.“除杂1”调节pH最低值为9.6 |
C.检验MnOOH是否洗涤干净,可选用 溶液 溶液 |
| D.分离产品的操作是过滤、洗涤、低温干燥 |
您最近一年使用:0次
2023·山东枣庄·二模
名校
9 . 高铁酸钾( )具有杀菌消毒及净水作用,某实验小组在碱性条件下制备
)具有杀菌消毒及净水作用,某实验小组在碱性条件下制备 流程如图所示:
流程如图所示:
 )具有杀菌消毒及净水作用,某实验小组在碱性条件下制备
)具有杀菌消毒及净水作用,某实验小组在碱性条件下制备 流程如图所示:
流程如图所示: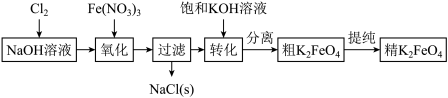
A.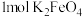 消毒能力相当于1.5mol HClO 消毒能力相当于1.5mol HClO |
B.氧化反应: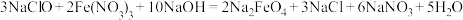 |
| C.同温度时高铁酸钠溶解度大于高铁酸钾 |
| D.提纯时,应用到的玻璃仪器有蒸发皿、玻璃棒、烧杯、酒精灯 |
您最近一年使用:0次
2023-03-24更新
|
752次组卷
|
7卷引用:考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期10月月考化学试题黑龙江省牡丹江市第二高级中学2023-2024学年高三上学期第二次阶段性考试化学试题山东省枣庄市2023届高三二模考试化学试题江西省宜丰中学、宜春一中 2022-2023学年高二下学期4月期中联考化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题6-10)江西省贵溪市实验中学2023-2024学年高三下学期4月第二次月考化学试卷






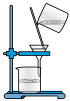
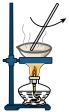
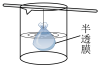
 又名“大苏打”“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,在中性和碱性环境中稳定。某化学实验小组用如图1装置(略去对乙的加热装置)制备
又名“大苏打”“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,在中性和碱性环境中稳定。某化学实验小组用如图1装置(略去对乙的加热装置)制备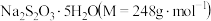 。
。 
 和
和 的混合物)制备
的混合物)制备 晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液,
晶体,将下列实验方案补充完整:将固体混合物溶于水配成溶液, 计)
计)


