名校
解题方法
1 . Ⅰ.为测定金属钠样品(表面有 )中钠单质的质量分数,设计了如下实验(反应装置如图所示,U形管中的无水
)中钠单质的质量分数,设计了如下实验(反应装置如图所示,U形管中的无水 用作干燥剂)
用作干燥剂)

①称量A、B装置的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管的橡皮塞有关数据:称取的金属钠样品质量为ag,A、B装置反应前总质量为bg,反应后总质量为cg。
请根据题意回答下列问题:
(1)钠与水反应的化学方程式为_____ 。
(2)用a、b、c表示的钠单质的质量分数为_____ 。
(3)没有B装置对测定结果有何影响?______ (填“偏大”“偏小”或“不影响”)。
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,装置如图所示。
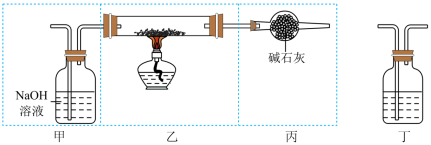
请回答下列问题:
(1)为完成实验应将装置丁接在装置_____ 和______ 之间(填“甲”“乙”或“丙”),且装置丁中盛放的试剂是_____ 。
(2)装置丙的作用是_____ 。
(3)为制得更纯的Na2O2,应先______ ,后_____ 。
(4)点燃酒精灯后,观察到装置乙中的现象为______ 。
 )中钠单质的质量分数,设计了如下实验(反应装置如图所示,U形管中的无水
)中钠单质的质量分数,设计了如下实验(反应装置如图所示,U形管中的无水 用作干燥剂)
用作干燥剂)
①称量A、B装置的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管的橡皮塞有关数据:称取的金属钠样品质量为ag,A、B装置反应前总质量为bg,反应后总质量为cg。
请根据题意回答下列问题:
(1)钠与水反应的化学方程式为
(2)用a、b、c表示的钠单质的质量分数为
(3)没有B装置对测定结果有何影响?
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,装置如图所示。

请回答下列问题:
(1)为完成实验应将装置丁接在装置
(2)装置丙的作用是
(3)为制得更纯的Na2O2,应先
(4)点燃酒精灯后,观察到装置乙中的现象为
您最近一年使用:0次
2020-10-08更新
|
250次组卷
|
6卷引用:江苏省泰州中学2022-2023学年高一上学期第一次月考化学试题
江苏省泰州中学2022-2023学年高一上学期第一次月考化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4(已下线)1.2.1 研究物质的基本方法-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)2.1.1 钠及其氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第一册)黑龙江省牡丹江市第三高级中学2022-2023学年高一上学期第一次月考化学试题山东省曹县苏教实验高级中学2021-2022学年高一上学期第一次月考化学试题
2 . 2015年冬天,我国多地发生了严重的雾霾天气,这种天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。

(1)结合实验目的,装置(Ⅲ)的主要作用为_______ 。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是_________ 。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后添加_______ 。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,观察和分析上述反应,则a、b应满足的关系为___ 。Na2CO3溶液的物质的量浓度为__ mol·L-1(不必化简)。

(1)结合实验目的,装置(Ⅲ)的主要作用为
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后添加
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,观察和分析上述反应,则a、b应满足的关系为
您最近一年使用:0次
2017-11-27更新
|
846次组卷
|
4卷引用:【全国百强校】江苏省启东中学2018-2019学年高一下学期3月月考化学试题
【全国百强校】江苏省启东中学2018-2019学年高一下学期3月月考化学试题(已下线)同步君 必修1 第4章 第3节 二氧化氮和一氧化氮高中化学人教版 必修1 第四章 非金属及其化合物 3.硫和氮的氧化物 二氧化氮和一氧化氮福建省南安市侨光中学2018-2019学年高一5月月考化学试题
名校
解题方法
3 . 以海水为原料可获得钠、镁等金属及其化合物。
(1)将金属钠分别放入下列溶液中,既有气体产生,又有沉淀产生的是_____ (填序号,下同)
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④CuSO4溶液 ⑤饱和石灰水
溶液 ④CuSO4溶液 ⑤饱和石灰水
(2)某实验小组通过如图所示实验,探究 与水的反应,下列说法正确的是_____。
与水的反应,下列说法正确的是_____。

(3)某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。
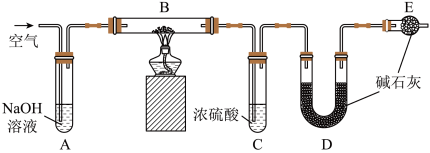
①加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用_______ ,停止加热后,还需继续通入一段时间的空气,目的是_______ 。
②将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为___________ ;样品产生的二氧化碳的质量可通过测定实验前后装置_____ (填装置对应的标号)的质量测得。
③若没有装置E,可能会造成测定结果_______ (填“偏大”、“偏小”或“不变”)。
④实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为______ L,膨松剂样品中所含碳酸氢钠的物质的量为_____ mol。
(1)将金属钠分别放入下列溶液中,既有气体产生,又有沉淀产生的是
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④CuSO4溶液 ⑤饱和石灰水
溶液 ④CuSO4溶液 ⑤饱和石灰水(2)某实验小组通过如图所示实验,探究
 与水的反应,下列说法正确的是_____。
与水的反应,下列说法正确的是_____。
| A.②中的大量气泡主要成分是氢气 |
| B.③中溶液变红,说明有酸性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
D.⑤中 的主要作用是降低了水中氧气的溶解度 的主要作用是降低了水中氧气的溶解度 |
(3)某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。

①加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用
②将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为
③若没有装置E,可能会造成测定结果
④实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为
您最近一年使用:0次
名校
4 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置(夹持装置略),采用碘量法测定学校周边河水中的溶解氧的含量。
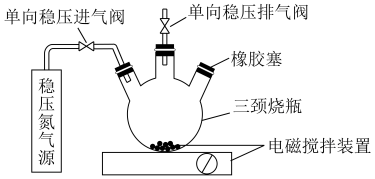
实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成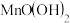 ,实现氧的固定。
,实现氧的固定。
II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至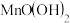 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
e.在暗处静置5min后,取一定量溶液,用 标准溶液滴定生成的
标准溶液滴定生成的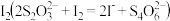 ,记录数据。
,记录数据。
f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为___________ 。
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是___________ 。
(3)“氧的固定”中发生主要反应的化学方程式为___________ 。
(4)“步骤e”中,用a
 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为______________ ;若200mL水样经处理后,共消耗 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为___________ (用含字母的式子表示) 。
。

实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL
 无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成
无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成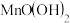 ,实现氧的固定。
,实现氧的固定。II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
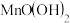 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。e.在暗处静置5min后,取一定量溶液,用
 标准溶液滴定生成的
标准溶液滴定生成的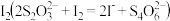 ,记录数据。
,记录数据。f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为
(2)取水样时应尽量避免扰动水体表面,这样操作的主要目的是
(3)“氧的固定”中发生主要反应的化学方程式为
(4)“步骤e”中,用a

 标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为 标准溶液的体积为b mL,则水样中溶解氧的含量为
标准溶液的体积为b mL,则水样中溶解氧的含量为 。
。
您最近一年使用:0次
名校
解题方法
5 . 石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。已知:实验前后,各通入一次N2,将装置中的气体全部赶入到U型管中。
(1)石墨烯与金刚石互称为_______ (选填同分异构体、同素异形体);写出电热炉中石墨烯和浓硫酸反应化学方程式_______ 。
(2)足量酸性KMnO4溶液的作用_______ ,能否用足量NaHCO3溶液代替KMnO4溶液,若不能,说明原因_______ 。
(3)实验结束后,若U型管增重mg,则复合材料中石墨烯的质量分数为_______ (用字母表示)。
(4)实验完毕后,将三口烧瓶里的混合物倒入盛有水的烧杯中,搅拌,静置,过滤,得到蓝色溶液和黑色固体。现探究该黑色固体成分。

取所配制的溶液25mL于锥形瓶中,加入40mL0.1mol/L的NaOH溶液恰好完全反应,则X是_______ (填化学式)。

(1)石墨烯与金刚石互称为
(2)足量酸性KMnO4溶液的作用
(3)实验结束后,若U型管增重mg,则复合材料中石墨烯的质量分数为
(4)实验完毕后,将三口烧瓶里的混合物倒入盛有水的烧杯中,搅拌,静置,过滤,得到蓝色溶液和黑色固体。现探究该黑色固体成分。

取所配制的溶液25mL于锥形瓶中,加入40mL0.1mol/L的NaOH溶液恰好完全反应,则X是
您最近一年使用:0次
名校
解题方法
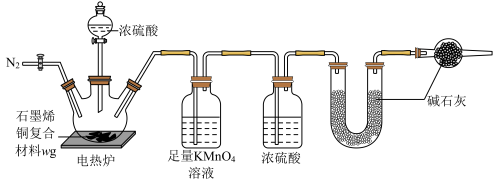
6 . I.现有一定量含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水)。回答下列问题:
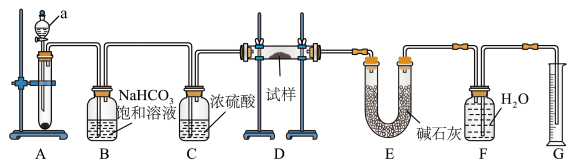
(1)装置a的名称为_____ 。
(2)装置B中除杂反应的离子方程式为_________ 。
(3)装置D中反应的化学方程式为_______ 。
(4)装置E中碱石灰的主要作用是________ 。
(5)已知装置D中试样质量为19.5g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数___________ 。
Ⅱ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
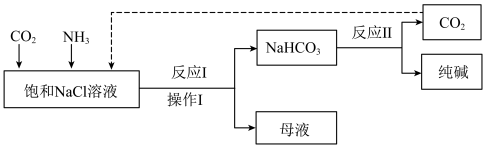
(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为_____ 。
A.先通CO2再通NH3 B.先通NH3再通CO2

(1)装置a的名称为
(2)装置B中除杂反应的离子方程式为
(3)装置D中反应的化学方程式为
(4)装置E中碱石灰的主要作用是
(5)已知装置D中试样质量为19.5g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数
Ⅱ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

(6)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.先通CO2再通NH3 B.先通NH3再通CO2
您最近一年使用:0次
名校
解题方法
7 . 以废锰酸锂电池为原料,回收MnO2、精铜的实验流程如下:
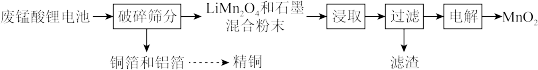
(1)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC LiMn2O4+C(0<x<1)。试写出放电时负极反应式:
LiMn2O4+C(0<x<1)。试写出放电时负极反应式:_______ 。
(2)“浸取”在如图所示装置中进行。
①将一定量“LiMn2O4和石墨混合粉末”与H2SO4溶液、H2O2溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过分液漏斗缓慢滴加另一种溶液。分液漏斗中的溶液是_______ 。
②保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有_______ 、_______ 。(填写两点)
(3)补充以“铜箔和铝箔”为原料制备精铜的实验方案:_______ ;在H2SO4-CuSO4混合溶液中电解,当铜箔完全溶解时取出不锈钢片,刮出精铜将所得精铜用蒸馏水洗净,干燥。实验中须使用的试剂:1.0mol/LNaOH溶液、不锈钢片,除常用仪器外须使用的仪器:直流电源。
(4)通过下列方法测定MnO2的纯度:准确称取0.5000g MnO2样品,加入30.00mL 0.2000mol·L-1 Na2C2O4溶液和适量硫酸,加热至完全反应;用0.01000mol·L-1 KMnO4标准溶液滴定过量的Na2C2O4至终点,消耗KMnO4标准溶液20.00mL。计算样品中MnO2的质量分数(写出计算过程)_______ 。已知:MnO2+C2O +4H+=Mn2++2CO2↑+2H2O、2MnO
+4H+=Mn2++2CO2↑+2H2O、2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。
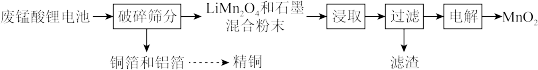
(1)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC
 LiMn2O4+C(0<x<1)。试写出放电时负极反应式:
LiMn2O4+C(0<x<1)。试写出放电时负极反应式:(2)“浸取”在如图所示装置中进行。

①将一定量“LiMn2O4和石墨混合粉末”与H2SO4溶液、H2O2溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过分液漏斗缓慢滴加另一种溶液。分液漏斗中的溶液是
②保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有
(3)补充以“铜箔和铝箔”为原料制备精铜的实验方案:
(4)通过下列方法测定MnO2的纯度:准确称取0.5000g MnO2样品,加入30.00mL 0.2000mol·L-1 Na2C2O4溶液和适量硫酸,加热至完全反应;用0.01000mol·L-1 KMnO4标准溶液滴定过量的Na2C2O4至终点,消耗KMnO4标准溶液20.00mL。计算样品中MnO2的质量分数(写出计算过程)
 +4H+=Mn2++2CO2↑+2H2O、2MnO
+4H+=Mn2++2CO2↑+2H2O、2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。
+16H+=2Mn2++10CO2↑+8H2O。
您最近一年使用:0次
名校
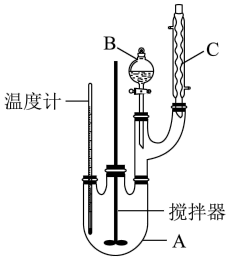
8 . 某科学小组制备硝基苯的实验装置如图,有关信息如下表:
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心地加入B中。把0.2mol(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,使溶液混合均匀。在50~60 °C下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 °C馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中B仪器的名称为___________ ,图 中装置C的作用是___________ 。
(2)制备硝基苯的化学方程式为___________ 。
(3)为了使反应在50~60°C下进行,常用的加热方式是___________ 。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是___________ (用化学方程式说明),实验室常用氢氧化钠溶液除去该有色物质,涉及的离子方程式为___________ 。
(4)将粗产品置于分液漏斗中加水,振荡后静置,产物应在___________ (填“ 上”或“下”)层。
(5)本实验所得到的硝基苯的产率是___________ (结果保留 3位有效数字)。
| 物质 | 熔点/°C | 沸点/°C | 密度 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 不溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | — | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | — | 338 | 1.84 | 易溶于水 |
取100 mL烧杯,用20 mL浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心地加入B中。把0.2mol(15.6 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,使溶液混合均匀。在50~60 °C下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 °C馏分,得到纯硝基苯18g。

回答下列问题:
(1)图中B仪器的名称为
(2)制备硝基苯的化学方程式为
(3)为了使反应在50~60°C下进行,常用的加热方式是
(4)将粗产品置于分液漏斗中加水,振荡后静置,产物应在
(5)本实验所得到的硝基苯的产率是
您最近一年使用:0次
2022-06-01更新
|
450次组卷
|
3卷引用:江苏省泰州中学2021-2022学年高一下学期第二次月度检测化学试题
江苏省泰州中学2021-2022学年高一下学期第二次月度检测化学试题(已下线)【知识图鉴】单元讲练测选择性必修3第2单元02基础练广东省深圳市龙岗区德琳学校2021-2022学年高二下学期期中考试化学试题



