1 . 碱式碳酸铜 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.配制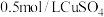 溶液和
溶液和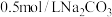 溶液各
溶液各 。
。
Ⅱ.取 所配
所配 溶液,按照
溶液,按照 和
和 的物质的量之比
的物质的量之比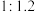 进行混合,在
进行混合,在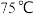 下搅拌反应产生蓝绿色沉淀。
下搅拌反应产生蓝绿色沉淀。
Ⅲ.待沉淀完全后减压过滤,用乙醇淋洗,干燥。
回答下列问题:
(1)步骤Ⅰ中,配制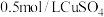 溶液时,不需要使用下列仪器中的
溶液时,不需要使用下列仪器中的___________ (填仪器名称)。___________ ,步骤Ⅲ中检验沉淀是否洗净的操作为___________ 。
(3)步骤Ⅲ中用乙醇淋洗的原因是___________ 。
Ⅳ.碱式碳酸铜纯度的测定:同学们设计了如图装置对制得的 蓝绿色固体进行实验。
蓝绿色固体进行实验。 装置加热前,需要首先打开活塞
装置加热前,需要首先打开活塞 ,用
,用 装置制取适量
装置制取适量 ,然后关闭
,然后关闭 ,点燃
,点燃 处酒精灯。装置A中发生反应的离子程式为
处酒精灯。装置A中发生反应的离子程式为___________ ,C中盛装的试剂应是___________ 。
(5)装置 的作用为
的作用为___________ 。
(6)待固体完全分解后,测得装置E增重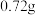 ,则该碱式碳酸铜的纯度为
,则该碱式碳酸铜的纯度为___________  (保留1位小数)。
(保留1位小数)。
 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:Ⅰ.配制
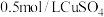 溶液和
溶液和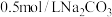 溶液各
溶液各 。
。Ⅱ.取
 所配
所配 溶液,按照
溶液,按照 和
和 的物质的量之比
的物质的量之比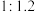 进行混合,在
进行混合,在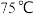 下搅拌反应产生蓝绿色沉淀。
下搅拌反应产生蓝绿色沉淀。Ⅲ.待沉淀完全后减压过滤,用乙醇淋洗,干燥。
回答下列问题:
(1)步骤Ⅰ中,配制
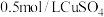 溶液时,不需要使用下列仪器中的
溶液时,不需要使用下列仪器中的
(3)步骤Ⅲ中用乙醇淋洗的原因是
Ⅳ.碱式碳酸铜纯度的测定:同学们设计了如图装置对制得的
 蓝绿色固体进行实验。
蓝绿色固体进行实验。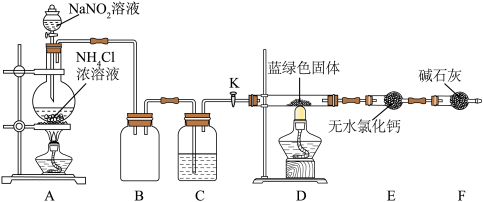
 装置加热前,需要首先打开活塞
装置加热前,需要首先打开活塞 ,用
,用 装置制取适量
装置制取适量 ,然后关闭
,然后关闭 ,点燃
,点燃 处酒精灯。装置A中发生反应的离子程式为
处酒精灯。装置A中发生反应的离子程式为(5)装置
 的作用为
的作用为(6)待固体完全分解后,测得装置E增重
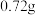 ,则该碱式碳酸铜的纯度为
,则该碱式碳酸铜的纯度为 (保留1位小数)。
(保留1位小数)。
您最近一年使用:0次
解题方法
2 . 某实验小组对一种染料废水进行处理,获得Na2SO4并测定废水的总有机碳(总有机碳是指单位体积水样中溶解或悬浮的有机物碳元素质量总和,是水体评价的综合指标之一)。
实验步骤为:
①取100mL废水(假定有机成分只有萘磺酸钠),在35℃下加入等体积甲醇,充分混合后,冷却、过滤,得到固体A和滤液B。
②经检测,固体A主要成分为Na2SO4,并含有少量Na2SO3和萘磺酸钠;滤液B含2.3g萘磺酸钠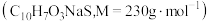 。
。
③一定温度下,从滤液B中回收甲醇;再蒸发浓缩析出萘磺酸钠,过滤,得滤液C,向滤液C中加入适量的NaClO溶液去除少量的 和NH3。
和NH3。
④按下图实验装置(部分装置略)对固体A进行处理,完全反应后Pt坩埚中固体为Na2SO4。
回答下列问题:
(1)实验步骤①中加入甲醇的目的为_______ 。
(2)实验步骤③中回收甲醇的操作名称是_______ ,去除NH3生成N2反应的离子方程式为_______ 。
(3)通入N2的目的是_______ 。
(4)酸性KMnO4溶液的作用是_______ ,试剂 是
是_______ 。
(5)改为通入O2前,需_______(填标号)。
(6)反应后U形管(含试剂)增重0.44g,该废水总有机碳=_______  (用科学记数法表示)。
(用科学记数法表示)。
实验步骤为:
①取100mL废水(假定有机成分只有萘磺酸钠),在35℃下加入等体积甲醇,充分混合后,冷却、过滤,得到固体A和滤液B。
②经检测,固体A主要成分为Na2SO4,并含有少量Na2SO3和萘磺酸钠;滤液B含2.3g萘磺酸钠
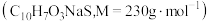 。
。③一定温度下,从滤液B中回收甲醇;再蒸发浓缩析出萘磺酸钠,过滤,得滤液C,向滤液C中加入适量的NaClO溶液去除少量的
 和NH3。
和NH3。④按下图实验装置(部分装置略)对固体A进行处理,完全反应后Pt坩埚中固体为Na2SO4。
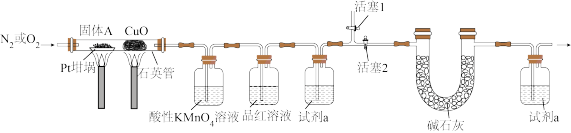
回答下列问题:
(1)实验步骤①中加入甲醇的目的为
(2)实验步骤③中回收甲醇的操作名称是
(3)通入N2的目的是
(4)酸性KMnO4溶液的作用是
 是
是(5)改为通入O2前,需_______(填标号)。
| A.打开活塞1 | B.打开活塞2 | C.关闭活塞1 | D.关闭活塞2 |
(6)反应后U形管(含试剂)增重0.44g,该废水总有机碳=
 (用科学记数法表示)。
(用科学记数法表示)。
您最近一年使用:0次
2024-01-20更新
|
1004次组卷
|
5卷引用:2024届陕西省宝鸡市高三下学期三模考试理科综合试题-高中化学
2024届陕西省宝鸡市高三下学期三模考试理科综合试题-高中化学2024年1月河南普通高等学校招生考试适应性测试化学试题(已下线)T27-实验综合题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升(已下线)热点22 定量分析型实验综合题
名校
解题方法
3 .  (草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(一)乙炔的制备

已知:电石的主要成分是 ,还有少量的CaS、
,还有少量的CaS、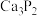 。
。
(1)用饱和食盐水代替水的目的是___________ 。
(2)装置B中 溶液的作用是
溶液的作用是___________ 。
(3)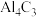 常用作甲烷发生剂,根据
常用作甲烷发生剂,根据 和饱和食盐水制取
和饱和食盐水制取 的原理,写出
的原理,写出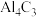 与饱和食盐水反应的化学方程式:
与饱和食盐水反应的化学方程式:___________ 。
(二)草酸的制备
(4) 通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为___________ ,研究表明当硝酸的质量分数超过50%或温度高于40℃,草酸的产率开始下降,其原因是___________ 。

(5)装置G的作用是___________ 。
(三)草酸纯度的测定
步骤1.称取15.0g草酸样品,配制成100mL溶液。
步骤2.量取25mL所配制的溶液于锥形瓶中,加入 酸性
酸性 溶液充分反应。
溶液充分反应。
步骤3.向反应后的溶液中加入 溶液至溶液中紫红色褪去,消耗
溶液至溶液中紫红色褪去,消耗 溶液体积为
溶液体积为 。
。
(6)上述过程中发生反应的离子方程式为___________ 。
(7)原试样中草酸的质量分数为___________ (列式即可,不用化简)。
 (草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。
(草酸,熔点为:101∼102℃,189.5℃时分解)是常见的有机化工原料,广泛用于医药、冶金和化工等,其用量随着工业的大力发展不断增加。由乙炔和硝酸为原料制备草酸过程简单,易实现连续化、自动化,是煤化工路线合成草酸的一条新途径。(一)乙炔的制备

已知:电石的主要成分是
 ,还有少量的CaS、
,还有少量的CaS、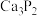 。
。(1)用饱和食盐水代替水的目的是
(2)装置B中
 溶液的作用是
溶液的作用是(3)
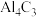 常用作甲烷发生剂,根据
常用作甲烷发生剂,根据 和饱和食盐水制取
和饱和食盐水制取 的原理,写出
的原理,写出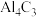 与饱和食盐水反应的化学方程式:
与饱和食盐水反应的化学方程式:(二)草酸的制备
(4)
 通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
通入装置F后能观察到有红棕色气体产生,则装置F中发生反应的化学方程式为
(5)装置G的作用是
(三)草酸纯度的测定
步骤1.称取15.0g草酸样品,配制成100mL溶液。
步骤2.量取25mL所配制的溶液于锥形瓶中,加入
 酸性
酸性 溶液充分反应。
溶液充分反应。步骤3.向反应后的溶液中加入
 溶液至溶液中紫红色褪去,消耗
溶液至溶液中紫红色褪去,消耗 溶液体积为
溶液体积为 。
。(6)上述过程中发生反应的离子方程式为
(7)原试样中草酸的质量分数为
您最近一年使用:0次
解题方法
4 . 一种测定黄铁矿(主要成分为FeS2,杂质不含硫)中硫含量的实验原理及步骤如下:

已知:I.2FeS2+15Na2O2 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;
II.Pb2++ =PbSO4↓;
=PbSO4↓;
III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为_______ mol。
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为_______ 。
(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是_______ 。
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为_______ (填字母)。
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为_______ (用含c、V的代数式表示)。
③下列情形下会使测得的硫的质量分数偏大的是_______ (填字母)。
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视

已知:I.2FeS2+15Na2O2
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;II.Pb2++
 =PbSO4↓;
=PbSO4↓;III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3
 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为
③下列情形下会使测得的硫的质量分数偏大的是
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视
您最近一年使用:0次
名校
解题方法
5 . 某研究性学习小组对亚硫酸钠的组成及性质进行探究。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有_______ (填“氧化性”或“还原性”),反应的离子方程式为_______ 。
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是_______ 。
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。
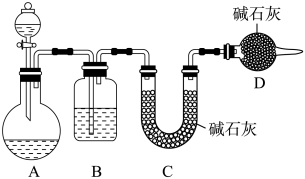
量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是_______ ;缺少B装置,测定的变质的百分率将会_______ (填“偏高”、“偏低”或“不变”)。
②该实验装置中存在的明显缺陷是_______ 。改进缺陷后再进行实验,若实验前后测得C装置增重3.2g,则Na2SO3变质的百分率为_______ 。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。

量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是
②该实验装置中存在的明显缺陷是
您最近一年使用:0次
名校
解题方法
6 . 连二亚硫酸钠( )是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产
)是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产 ,的装置如图甲所示。
,的装置如图甲所示。

在C中按照一定质量比加入甲醇和水,再加入适量甲酸钠和氢氧化钠固体,溶解。回答下列问题:
(1)仪器e的名称为___________ ,装置B的作用为___________ 。
(2)装置A中烧瓶内发生反应的离子方程式为___________ 。
(3) 与稀硫酸作用的离子方程式为
与稀硫酸作用的离子方程式为___________ ,反应过程中应该控制 的通入量,原因是
的通入量,原因是___________ 。
(4) 的制备原理为
的制备原理为 。用单线桥法标注电子转移的方向和数目
。用单线桥法标注电子转移的方向和数目___________ 。
(5)图乙为保险粉含量测定装置。称取样品 加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加
加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加 溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗
溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗 的
的 溶液
溶液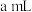 。
。

①图乙中2为 入口,通入
入口,通入 的作用是
的作用是___________ 。
②样品中连二亚硫酸钠的含量为___________ (用含 ,
, 的式子表示)。
的式子表示)。
 )是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产
)是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产 ,的装置如图甲所示。
,的装置如图甲所示。
在C中按照一定质量比加入甲醇和水,再加入适量甲酸钠和氢氧化钠固体,溶解。回答下列问题:
(1)仪器e的名称为
(2)装置A中烧瓶内发生反应的离子方程式为
(3)
 与稀硫酸作用的离子方程式为
与稀硫酸作用的离子方程式为 的通入量,原因是
的通入量,原因是(4)
 的制备原理为
的制备原理为 。用单线桥法标注电子转移的方向和数目
。用单线桥法标注电子转移的方向和数目(5)图乙为保险粉含量测定装置。称取样品
 加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加
加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加 溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗
溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗 的
的 溶液
溶液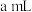 。
。
①图乙中2为
 入口,通入
入口,通入 的作用是
的作用是②样品中连二亚硫酸钠的含量为
 ,
, 的式子表示)。
的式子表示)。
您最近一年使用:0次
2021-09-09更新
|
1020次组卷
|
3卷引用:陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题



