名校
解题方法
1 . 现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、 、
、 ,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
 、
、 ,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )
,现取三份各100 mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08 mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。以下结论正确的是( )A.该混合液中一定含有:K+、 、 、 、 、 ,可能含Cl- ,可能含Cl- |
B.该混合液中一定含有: 、 、 、 、 ,可能含K+、Cl- ,可能含K+、Cl- |
C.该混合液中一定含有: 、 、 、 、 ,可能含Mg2+、K+、Cl- ,可能含Mg2+、K+、Cl- |
D.该混合液中一定含有: 、 、 ,可能含Mg2+、K+、Cl- ,可能含Mg2+、K+、Cl- |
您最近一年使用:0次
2020-10-12更新
|
280次组卷
|
2卷引用:福建省福州市罗源第一中学2021届高三上学期10月月考化学试题
名校
解题方法
2 . 某溶液中可能含有H+、NH 、Mg2+、 Al3+、Fe3+、CO
、Mg2+、 Al3+、Fe3+、CO 、SO
、SO 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
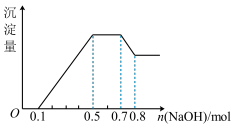
 、Mg2+、 Al3+、Fe3+、CO
、Mg2+、 Al3+、Fe3+、CO 、SO
、SO 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是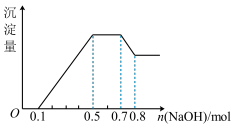
A.溶液中一定含有NH | B.溶液中一定含有Al3+ |
C.溶液中一定含有NO | D.溶液中一定含有SO |
您最近一年使用:0次
2020-07-21更新
|
557次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
3 . 某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、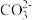 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是

 、
、 、
、 、Cl-、Br-、
、Cl-、Br-、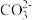 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是
A.Ba2+、Fe3+、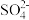 、 、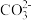 肯定不存在,Na+、K+肯定存在 肯定不存在,Na+、K+肯定存在 |
B.原溶液肯定不含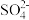 和 和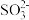 |
| C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响 |
D.是否含 需另做实验判断 需另做实验判断 |
您最近一年使用:0次
2020-06-22更新
|
426次组卷
|
5卷引用:陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题
4 . 某固体混合物,可能含有FeSO4、CuSO4、MgBr2、Na2SO3和KCl中的几种,进行如下实验:
①取样溶于水,得澄清透明溶液
②样品溶液中滴加过量氯水,再滴加过量BaCl2溶液,得白色沉淀1,过滤,将滤液一分为二
③往其中一份滤液中加入CCl4,振荡,溶液分层,上层用淀粉-KI试纸检验呈蓝色,下层呈橙红色
④另一份滤液中加入过量的NaOH,得沉淀2,用盐酸完全溶解沉淀2,滴加Na2S溶液,可见淡黄色浑浊
下列判断不正确的是( )
①取样溶于水,得澄清透明溶液
②样品溶液中滴加过量氯水,再滴加过量BaCl2溶液,得白色沉淀1,过滤,将滤液一分为二
③往其中一份滤液中加入CCl4,振荡,溶液分层,上层用淀粉-KI试纸检验呈蓝色,下层呈橙红色
④另一份滤液中加入过量的NaOH,得沉淀2,用盐酸完全溶解沉淀2,滴加Na2S溶液,可见淡黄色浑浊
下列判断不正确的是( )
| A.沉淀2中既有氢氧化镁也有氢氧化铁 |
| B.固体混合物中一定不存在Na2SO3 |
| C.由淀粉-KI试纸检验呈蓝色可知一定有FeSO4 |
| D.固体混合物中不存在CuSO4 |
您最近一年使用:0次
5 . 某兴趣小组对实验室中的一种白色固体进行鉴别,实验探究如下:
①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;
②用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰;
③取少量溶液A加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;
④另取少量溶液A加入硫粉,加热,硫溶解生成无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和刺激性气味的气体;若将溶液B加入 沉淀中,沉淀溶解。
沉淀中,沉淀溶解。
下列叙述错误的是( )
①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;
②用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰;
③取少量溶液A加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;
④另取少量溶液A加入硫粉,加热,硫溶解生成无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和刺激性气味的气体;若将溶液B加入
 沉淀中,沉淀溶解。
沉淀中,沉淀溶解。下列叙述错误的是( )
A.由实验可推测该白色固体为 或 或 |
B.实验③发生的离子方程式可能为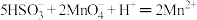 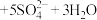 |
C.实验④中生成无色溶液B的化学方程式为: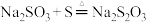 |
D.由实验④可知 可以和 可以和 形成配合物 形成配合物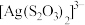 而溶解 而溶解 |
您最近一年使用:0次
解题方法
6 . 某固体混合物X,含有NH4NO3、AgNO3、Cu(NO3)2和NaNO3中的一种或几种,进行如下实验:
①取少量X溶于水,逐滴加入NaOH溶液直至过量,先出现沉淀Y,后沉淀溶解得到溶液Z,并释放出能使湿润红色石蕊试纸变蓝的气体A;
②往溶液Z中逐滴加入稀盐酸直至过量,先产生沉淀,后沉淀全部溶解。
下列说法不正确 的是( )
①取少量X溶于水,逐滴加入NaOH溶液直至过量,先出现沉淀Y,后沉淀溶解得到溶液Z,并释放出能使湿润红色石蕊试纸变蓝的气体A;
②往溶液Z中逐滴加入稀盐酸直至过量,先产生沉淀,后沉淀全部溶解。
下列说法
| A.气体A为NH3,溶液Z呈碱性 |
| B.通过上述实验无法确定是否存在NaNO3 |
| C.X中一定有NH4NO3和Cu(NO3)2,且n(NH4NO3) ≥ 4n[Cu(NO3)2] |
| D.向X中直接加入过量稀盐酸,最终固体能全部溶解 |
您最近一年使用:0次
7 . 通过实验得出的结论中正确的是
| A.将某纯净固体试样完全溶于盐酸,产生的气体能使品红试液褪色,加热后又变红,固体试样中一定存在SO32- |
| B.将某纯净固体试样加水溶解,加入NaOH溶液,微热,产生能使湿润红色石蕊试纸变蓝的气体,该固体试样中一定有NH4+ |
| C.将某纯净固体试样加水溶解,加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,试样中一定有SO42- |
| D.将某纯净固体试样完全溶于盐酸,加入KSCN溶液,若溶液变为血红色,试样中一定有Fe元素 |
您最近一年使用:0次
2020-04-27更新
|
246次组卷
|
2卷引用:浙江省丽水市2018-2019学年高二下学期教学质量监控化学试题
名校
8 . 硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
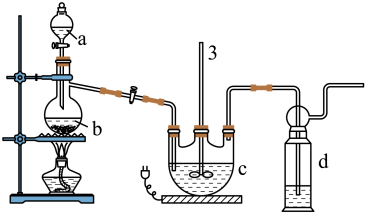
(1)仪器a的名称是_______ ,仪器b的名称是_______ 。b中利用质量分数为70%〜80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______ 。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______ mol∙L-1
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是
(2)实验中要控制SO2的生成速率,可以采取的措施有
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
| 装置 | 试剂X | 实验现象 |
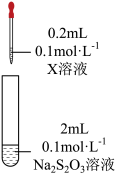 | Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为
您最近一年使用:0次
2020-04-20更新
|
817次组卷
|
6卷引用:2020届陕西省汉中市重点中学高三4月开学第一次联考理综-化学试题
解题方法
9 . 某混合溶液中可能大量含有的离子如下表所示:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
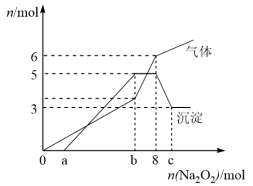
(1)该溶液中一定含有的阳离子是________________________________ ,其对应物质的量浓度之比为 ____________ ,溶液中一定不存在的阴离子是_______________________ 。
(2)写出沉淀减少的离子方程式________________________________________________ 。
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、OH-、CO32-、AlO2- |

(1)该溶液中一定含有的阳离子是
(2)写出沉淀减少的离子方程式
您最近一年使用:0次
解题方法
10 . 某溶液X中含有H+、 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、 、Cl−、Br−、
、Cl−、Br−、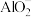 、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
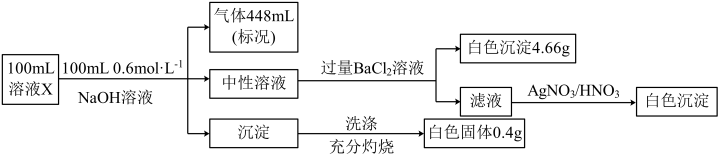
下列说法正确的是
 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、 、Cl−、Br−、
、Cl−、Br−、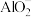 、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
下列说法正确的是
A.溶液X中一定没有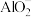 、SiO32-,可能有Na+、Fe2+ 、SiO32-,可能有Na+、Fe2+ |
| B.溶液X中加NaOH后,所得沉淀的成分可能有两种 |
| C.溶液X中c(Cl−)≤0.2 mol·L−1 |
| D.溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成 |
您最近一年使用:0次
2019-12-17更新
|
346次组卷
|
3卷引用:2019年11月浙江省温州市高三选考适应性测试化学试题



