名校
解题方法
1 . 已知还原性 >I-。某钠盐溶液可能含有阴离子Cl-、Br-、I-、
>I-。某钠盐溶液可能含有阴离子Cl-、Br-、I-、 、
、 、
、 。为鉴定这些离子,分别取少量溶液进行以下实验:
。为鉴定这些离子,分别取少量溶液进行以下实验:
①用pH试纸测得混合液呈碱性;
②加盐酸后生成无色气体,该气体能使饱和石灰水变浑浊;
③滴加少量氯水,加CCl4振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中产生白色沉淀。
下列有关说法正确的是( )
 >I-。某钠盐溶液可能含有阴离子Cl-、Br-、I-、
>I-。某钠盐溶液可能含有阴离子Cl-、Br-、I-、 、
、 、
、 。为鉴定这些离子,分别取少量溶液进行以下实验:
。为鉴定这些离子,分别取少量溶液进行以下实验:①用pH试纸测得混合液呈碱性;
②加盐酸后生成无色气体,该气体能使饱和石灰水变浑浊;
③滴加少量氯水,加CCl4振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中产生白色沉淀。
下列有关说法正确的是( )
A.由实验①和②可确定溶液中一定含有 | B.由实验③可确定溶液中一定不含Br-、I- |
C.由实验④可确定溶液中一定含有 | D.该溶液中一定含有I-、 ,可能含有 ,可能含有 |
您最近一年使用:0次
2 . 某无色透明溶液中可能含有 、
、 、
、 、K+、Na+、Cl-、Fe2+等离子。溶液中每种离子的数目相等。现取少量此溶液样品,进行如下实验:
、K+、Na+、Cl-、Fe2+等离子。溶液中每种离子的数目相等。现取少量此溶液样品,进行如下实验:
①加入足量BaCl2溶液,产生白色沉淀,该沉淀不溶于稀硝酸。
②取上述反应的滤液,加入硝酸酸化的AgNO3溶液后无气泡生成,产生白色沉淀。
根据上述实验现象,以下说法正确的是
 、
、 、
、 、K+、Na+、Cl-、Fe2+等离子。溶液中每种离子的数目相等。现取少量此溶液样品,进行如下实验:
、K+、Na+、Cl-、Fe2+等离子。溶液中每种离子的数目相等。现取少量此溶液样品,进行如下实验:①加入足量BaCl2溶液,产生白色沉淀,该沉淀不溶于稀硝酸。
②取上述反应的滤液,加入硝酸酸化的AgNO3溶液后无气泡生成,产生白色沉淀。
根据上述实验现象,以下说法正确的是
| A.该溶液中一定没有Fe2+,一定有Cl- |
| B.该溶液一定有K+、Na+ |
C.该溶液一定有 ,可能有Cl- ,可能有Cl- |
D.该溶液中可能有K+、 |
您最近一年使用:0次
2024-08-28更新
|
446次组卷
|
2卷引用:浙江省台州市第一中学2023-2024学年高一上学期入学分班考试 化学试卷
解题方法
3 . 下列实验方案的设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 检验某白色粉末中是否含有SO | 取少量该粉末溶于足量稀盐酸中,加入BaCl2溶液 | 若溶液出现白色沉淀,则该白色粉末中含有SO |
| B | 探究ClO2的性质 | 取1mL0.02mol•L-1的该溶液滴入2mL0.1mol•L-1的K2S溶液中 | 若溶液出现淡黄色浑浊,则说明ClO2具有氧化性 |
| C | 判断苯酚和碳酸的酸性强弱 | 将2mL10%的Na2CO3溶液滴入2mL苯酚浊液中 | 若苯酚浊液变澄清,则苯酚的酸性比碳酸强 |
| D | 探究取代基对苯环的影响 | 取2mL甲苯,滴入0.05%的酸性KMnO4溶液5滴 | 用力振荡,若KMnO4溶液褪为无色,则证明取代基对苯环具有活化作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 小金将一定量的氢氧化钠溶液与稀硫酸混合,如图1所示,发现没有明显的现象。小金分别取烧杯B中溶液进行以下实验,结果如图2所示。以下说法正确的是
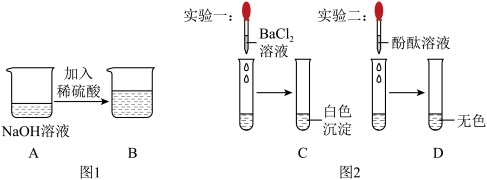
| A.实验一能证明图1中的反应已经发生 |
| B.D中溶液为无色,说明溶液中没有H2SO4 |
| C.将试管C静置,上层清液中一定含有的溶质是NaCl |
| D.根据实验一、二,可以判断氢氧化钠与硫酸恰好完全反应 |
您最近一年使用:0次
5 . 化学是一门以实验为基础的学科。
Ⅰ.[Cu(NH3)4]SO4·H2O 晶体制备。
向盛有 4 mL 0.1 mol/L CuSO4 溶液的试管里滴加几滴 1 mol/L 氨水,首先形成蓝色沉淀,继续添加氨水并振荡试管,可以观察到沉淀溶解,得到深蓝色透明溶液。再向试管中加入适量乙醇,并用玻璃棒摩擦试管壁,可以观察到有深蓝色的[Cu(NH3)4]SO4·H2O 晶体析出。回答下列问题:
(1)写出蓝色沉淀溶解得透明溶液的离子方程式_______ 。
(2)加入适量乙醇有深蓝色的[Cu(NH3)4]SO4·H2O 晶体析出的原因_______ 。
(3)设计检验晶体中是否含有 SO 的实验方案:
的实验方案:_______ 。
Ⅱ.探究卤代烃的消去反应的产物。
如图所示,向圆底烧瓶中加入2g NaOH和15mL无水乙醇,搅拌。再向其中加入5mL 溴乙烷和几片碎瓷片,微热。将产生的气体通入盛水的试管后,再用酸性高锰酸钾溶液进行检验。
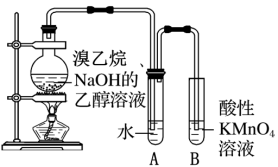
(4)气体在通入酸性高锰酸钾溶液前先通入盛水的试管是为了_______ 。
(5)若无A试管,B试管中应盛放试剂_______ 来检验消去反应产物。
(6)将气体缓慢通入酸性高锰酸钾溶液时发现小试管中溶液颜色褪色不明显。请结合以下资料:
资料1:溴乙烷发生消去反应比较适宜的反应温度为90 ℃~110 ℃,在该范围,温度越高,产生乙烯的速率越快。
资料2:溴乙烷的沸点:38.4 ℃。
分析可能的原因_______ 。
Ⅰ.[Cu(NH3)4]SO4·H2O 晶体制备。
向盛有 4 mL 0.1 mol/L CuSO4 溶液的试管里滴加几滴 1 mol/L 氨水,首先形成蓝色沉淀,继续添加氨水并振荡试管,可以观察到沉淀溶解,得到深蓝色透明溶液。再向试管中加入适量乙醇,并用玻璃棒摩擦试管壁,可以观察到有深蓝色的[Cu(NH3)4]SO4·H2O 晶体析出。回答下列问题:
(1)写出蓝色沉淀溶解得透明溶液的离子方程式
(2)加入适量乙醇有深蓝色的[Cu(NH3)4]SO4·H2O 晶体析出的原因
(3)设计检验晶体中是否含有 SO
 的实验方案:
的实验方案:Ⅱ.探究卤代烃的消去反应的产物。
如图所示,向圆底烧瓶中加入2g NaOH和15mL无水乙醇,搅拌。再向其中加入5mL 溴乙烷和几片碎瓷片,微热。将产生的气体通入盛水的试管后,再用酸性高锰酸钾溶液进行检验。

(4)气体在通入酸性高锰酸钾溶液前先通入盛水的试管是为了
(5)若无A试管,B试管中应盛放试剂
(6)将气体缓慢通入酸性高锰酸钾溶液时发现小试管中溶液颜色褪色不明显。请结合以下资料:
资料1:溴乙烷发生消去反应比较适宜的反应温度为90 ℃~110 ℃,在该范围,温度越高,产生乙烯的速率越快。
资料2:溴乙烷的沸点:38.4 ℃。
分析可能的原因
您最近一年使用:0次
6 . 下列对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,原物质一定有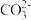 |
B.加入氯化钡溶液有白色沉淀产生,一定有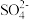 |
| C.加入硝酸银溶液产生白色沉淀,再加入稀硝酸,白色沉淀不消失,则原溶液一定有Cl- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
您最近一年使用:0次
2022-10-10更新
|
599次组卷
|
9卷引用:浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题
浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题黑龙江省大庆市大庆中学2022--2023学年高一上学期第一次月考化学试题福建省厦门双十中学2022-2023学年高一上学期期中考试化学试题福建省厦门双十中学2022-2023学年高一上学期化学期中考试化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一上学期11月期中考试化学试题吉林省四平市第一高级中学2023-2024学年高一上学期第二次月考化学试题黑龙江省大庆市大庆中学2023-2024学年高一上学期10月月考化学试题黑龙江省哈尔滨师范大学青冈实验中学2023-2024学年高一上学期期中考试化学试题
13-14高三上·上海·期中
7 . 某溶液中可能存在Br-、CO 、SO
、SO 、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定不存在的离子组是( )
 、SO
、SO 、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定不存在的离子组是( )
A.Al3+、Mg2+、SO |
B.Mg2+、CO 、I- 、I- |
C.Al3+、SO 、I- 、I- |
D.Al3+、Br-、SO |
您最近一年使用:0次
2020-08-15更新
|
1061次组卷
|
29卷引用:考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2014届上海市复旦大学附属中学高三上学期期中考试化学试卷(已下线)2014届上海市闵行区高三上学期期末教学质量检测化学试卷(已下线)2014届上海复旦附中第一学期期中考试高三化学试卷湖北省沙市中学2017-2018学年高二上学期第三次双周考试化学试题湖南省衡阳市第八中学2018届高三(实验班)上学期第一次质检化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】(已下线)2019年7月21日《每日一题》2020届高考一轮复习—— 每周一测山东省泰安市第一中学2020届高三10月月考化学试题上海市奉贤中学2019-2020学年高三化学10月月考试卷山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题安徽省宿州市灵璧中学2019-2020学年度高三上学期第三次月考化学试题(已下线)第07讲 离子共存 离子的检验和推断(精练)——2021年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题3 突破2 离子推断及鉴别人教版(2019)高一必修第一册 第一章 专题1 离子推断及鉴别安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题湖北松滋市言程中学2020-2021学年高一上学期9月月考化学试题湖南省宁乡市第一高级中学2021届高三上学期11月摸底考试化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)课时07 离子共存-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第3练 离子反应的应用(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海市吴淞中学2022-2023学年高三下学期第一次月考化学试题黑龙江省鸡西实验学校2023-2024学年高三上学期开学化学试题辽宁省辽西联合校2023-2024学年高三上学期期中考试化学试题
8 . 某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是_______ ,一定不含有的阳离子是_______ (写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是_______ ,④中生成白色沉淀的离子方程式是_______ 。
(3)该同学最终确定原溶液中所含阴离子是_______ ,阳离子是_______ (写离子符号)。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为_______ g。
| 阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、 、 、 、 、 、 、 |
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阴离子是
(2)③中加入少量盐酸生成无色气体的离子方程式是
(3)该同学最终确定原溶液中所含阴离子是
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
您最近一年使用:0次
2020-12-26更新
|
989次组卷
|
7卷引用:解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)重庆市第三十七中学校2021届高三9月月考化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题04 离子反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
9 . 下列方案的设计、现象和结论正确的是
| 方案设计 | 现象与结论 | ||
| A | 检验 是否有漂白性 是否有漂白性 | 将干燥的 通入放有鲜花的广口瓶 通入放有鲜花的广口瓶 | 若观察到鲜花褪色,则说明 具有漂白性 具有漂白性 |
| B | 证明 溶于水不能完全与水反应 溶于水不能完全与水反应 | 将 溶于水,观察氯水颜色,再滴加石蕊试液 溶于水,观察氯水颜色,再滴加石蕊试液 | 观察到氯水为淡黄绿色,且滴加石蕊试液先变红后褪色,说明 溶于水部分与水反应 溶于水部分与水反应 |
| C | 检验某溶液中是否存在 | 在溶液中加入 溶液,再加稀硝酸 溶液,再加稀硝酸 | 产生白色沉淀,加稀硝酸,沉淀不溶解说明溶液中存在 |
| D | 检验某溶液中是否存在 | 在溶液中加入 溶液 溶液 | 若产生白色沉淀说明溶液中存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-16更新
|
245次组卷
|
3卷引用:浙江省浙南名校联盟2023-2024学年高一上学期期中联考化学试题
名校
10 . 下列有关实验的叙述正确的是
A.取某固体试样溶于盐酸,滴加KSCN溶液不变红,说明该固体中一定不存在 |
| B.取某溶液试样进行焰色试验,通过蓝色钴玻璃观察火焰呈紫色,则其为钾盐溶液 |
| C.往某溶液试样中滴加酚酞试液,溶液变红色,则该溶液一定是碱溶液 |
D.取某溶液试样加足量硝酸无现象,再加 溶液产生白色沉淀,则原溶液中存在 溶液产生白色沉淀,则原溶液中存在 |
您最近一年使用:0次
2021-11-12更新
|
553次组卷
|
3卷引用:浙江省A9协作体2021-2022学年高一上学期期中考试化学试题



