1 . 利用如图所示装置制备NH3并对其性质进行检验,关闭K4、K2,打开K1、K3,使浓氨水和NaOH接触可生成NH3,待A中圆底烧瓶充满NH3时,关闭K1、K3,打开K4,下列说法错误的是
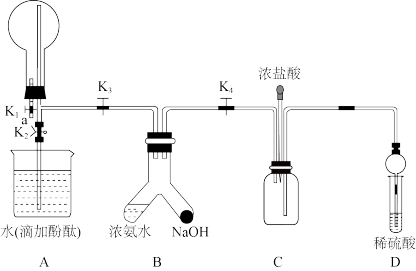

| A.可在a导管口处用干燥的蓝色石蕊试纸检验圆底烧瓶中是否充满NH3 |
| B.关闭K2,热敷圆底烧瓶可引发喷泉 |
| C.稍后挤压装浓盐酸滴管的胶头可在C中观察到白烟 |
| D.D中稀硫酸的作用为尾气吸收,其中干燥管能防止倒吸 |
您最近一年使用:0次
2 . 蛋白质是生命的物质基础。某学习小组实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_______ 。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
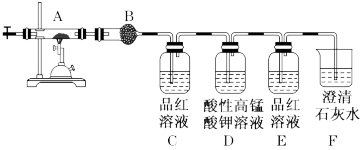
①装置B中的试剂是_______ 。
②装置D的作用是_______ 。
③当装置B、C、E、F依次出现下列现象:_______ ,品红溶液褪色,_______ ,出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2 +I2=
+I2=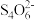 +2I-
+2I-
(3)写出二氧化硫与碘水反应的化学方程式:_______ 。
(4)滴定终点的现象为_______ 。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为_______ 。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值_______ (填“偏大*偏小”或“无影响”)。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是
②装置D的作用是
③当装置B、C、E、F依次出现下列现象:
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2
 +I2=
+I2= +2I-
+2I-(3)写出二氧化硫与碘水反应的化学方程式:
(4)滴定终点的现象为
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值
您最近一年使用:0次
名校
解题方法
3 . 有a、b、c、d、e五种气体,现进行下列实验:
则a、b、c、d、e依次可能是
| (1)a和b混合 | 气体变红棕色 |
| (2)c和d混合 | 产生白烟 |
| (3)c和e分别通入少量溴水中 | 溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 | 都产生淡黄色浑浊 |
| A.O2、NO、HCl、NH3、CO2 | B.O2、NO、NH3、HCl、SO3 |
| C.NO、O2、NH3、HCl、SO2 | D.HCl、CO2、NH3、H2S、CH4 |
您最近一年使用:0次
2020-10-30更新
|
852次组卷
|
38卷引用:湖南省邵阳市邵东县创新实验学校2021届高三上学期10月月考化学试题
湖南省邵阳市邵东县创新实验学校2021届高三上学期10月月考化学试题(已下线)2009-2010学年正定中学高二下学期期末考试化学(已下线)2010—2011学年安徽省师大附中高一下学期期中考查化学试卷(已下线)2012届广西桂林十八中高三上学期第三次月考化学试卷(已下线)2012届湖北省襄樊四中高三11月月考化学试卷(已下线)2014年高考化学鲁科版3.2氮的循环练习卷(已下线)2012届湖北省襄樊四中高三11月月考化学试卷2016届山东省实验中学高三上学期第二次诊断测试化学试卷2016届江西师大附中、临川一中高三上第一次联考化学试卷辽宁省大连市2017届高三3月双基测试化学试题陕西省西安市第一中学2018届高三上学期第一次考试化学试题辽宁省本溪市第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一下学期第一次月考化学试题【全国百强校】重庆市巴蜀中学2018-2019学年高一下学期第一次月考化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题河南省南阳市一中2020届高三上期第五次月考化学试题2020届高三化学二轮冲刺新题专练——氨气性质和应用人教版(2019)必修第二册第五章 模拟高考吉林省辽源市辽县第一高级中学2019-2020高一下学期期中考试化学试题必修第二册RJ第5章挑战区 模拟高考江西省南昌县莲塘第三中学2019-2020学年高一下学期期末考试化学试题山东省淄博市高青县第一中学2020-2021学年高二下学期第一次月考化学试题山东省淄博市沂源县第二中学2020-2021学年高一下学期期中考试化学试题河北省衡水市武强中学2020-2021学年高一下学期第一次月考化学试题浙江省绍兴市诸暨中学2020-2021学年高一下学期4月期中考试(实验班)化学试题云南省玉溪市华宁一中2020-2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 第二单元 重要的含氮化工原料 课时1 氨气甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题河北省张家口市第一中学2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第二十中学2019-2020学年高一下学期第一次月考化学试题甘肃省永昌县第一高级中学2021-2022高一下学期第一次月考化学试题河南省洛阳市洛阳格致学校2021-2022学年高一下学期三月月考化学试题黑龙江省哈尔滨市第十九中学2021-2022学年高三上学期第一次月考化学试题云南省富源县第一中学2021-2022高一下学期期中测试化学试题山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题陕西省西安市第一中学2022-2023学年高一下学期5月月考化学试题四川省眉山市仁寿县2022-2023学年高一下学期4月期中考试化学试题内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
4 . 绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是______ ,甲组由此得出绿矾的分解产物中含有SO2。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中______ (填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:
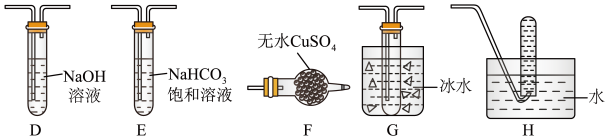
①丙组同学的实验装置中,依次连接的合理顺序为___________ 。
②能证明绿矾分解产物中有O2的检验方法是___________ 。
(4)配制FeSO4溶液需加入一定量的铁粉原因是(用离子方程式表示)___________ 。

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为
②能证明绿矾分解产物中有O2的检验方法是
(4)配制FeSO4溶液需加入一定量的铁粉原因是(用离子方程式表示)
您最近一年使用:0次
2020-10-14更新
|
186次组卷
|
2卷引用:湖南省株洲市第二中学2022-2023学年高一下学期第一次月考化学试题
5 . 实验室在 500 °C时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有 FeO、Fe2O3和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3和 SO2)。下列说法中正确的是( )
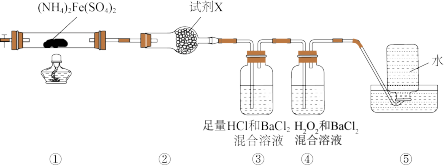

| A.装置②用于检验分解产物中是否有水蒸气生成, 试剂X 最好选用碱石灰 |
| B.装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3 |
| C.取①中固体残留物与稀硫酸反应并滴加 KSCN溶液,溶液变红色,则残留物一定为Fe2O3 |
| D.装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2 |
您最近一年使用:0次
2020-09-10更新
|
235次组卷
|
16卷引用:湖南省长沙市师大附中梅溪湖中学2020届高三上学期开学测试化学试题
湖南省长沙市师大附中梅溪湖中学2020届高三上学期开学测试化学试题安徽省皖南八校2018届高三第二次联考理综化学试题广东省江门市2018年高考模拟考试理综化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题15 物质的鉴别、分离、提纯类选择题解题方法和策略福建省福州市2018届高三下学期5月模拟考试理综化学试题(已下线)高考母题题源12 物质的检验、分离与提纯山东省济宁市第一中学2019届高三第一学期收心考试化学试题江苏省海安高级中学2019-2020学年高二上学期入学考试化学试题福建省2020届高三化学总复习专题训练——硫酸亚铁铵2020届高考化学二轮题型对题必练—— 物质组成的探究实验题(已下线)专题3.4 硫及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)第02讲 物质的分离和提纯(精练)——2021年高考化学一轮复习讲练测四川省成都市第七中学2021届高三上学期入学考试化学试题(已下线)第28讲 物质的分离、提纯、检验与鉴别(练) — 2022年高考化学一轮复习讲练测(新教材新高考)福建省德化一中、永安一中、漳平一中三校协作2021-2022学年高一下学期5月联考化学试题
名校
解题方法
6 . 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质。

(1)写出仪器B的名称:B:___ 。
(2)当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是___ (填序号)。
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
小颖认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气,该反应的化学方程式是___ ,她的做法是___ ;实验室还可以用高锰酸钾制取氧气,化学方程式为___ 。
(3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是___ ,可以观察到的现象是___ (C为干燥管,用于防止液体倒吸)。

(1)写出仪器B的名称:B:
(2)当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
小颖认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气,该反应的化学方程式是
(3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是
您最近一年使用:0次
名校
7 . 某混合气体可能有 、
、 、
、 、
、 、
、 和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,可判断该混合气体中一定有
和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,可判断该混合气体中一定有
 、
、 、
、 、
、 、
、 和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,可判断该混合气体中一定有
和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,可判断该混合气体中一定有A. 、 、 、 、 | B. 、 、 、 、 | C. 、 、 、 、 | D. 、 、 、 、 |
您最近一年使用:0次
2020-03-05更新
|
454次组卷
|
11卷引用:湖南省长沙市一中2017-2018学年度高一第一学期期末考试化学试题
湖南省长沙市一中2017-2018学年度高一第一学期期末考试化学试题(已下线)2011-2012学年浙江省瑞安市瑞祥高级中学高一上学期期末考试化学试卷(已下线)2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷2015-2016学年浙江省台州市书生中学高一上学期第一次月考化学试卷2015-2016学年浙江嘉兴一中高一上10月阶段测化学卷 2016-2017学年天津市武清区等五区县高一上期中化学试卷2016-2017学年河北省张家口第一中学高一下学期开学检测(衔接班)化学试卷2016-2017学年辽宁省庄河市高级中学高一4月月考化学试卷成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题人教版(2019)必修第二册第五章第二节 课时2 氨和铵盐必修第二册RJ第5章第二节 氮及其化合物 课时2 氨和铵盐
名校
8 . 碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____ 和_____ ;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____ 。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。____ 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____ ;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____ g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____ (填“合理”“不合理”),理由是_____ 。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。
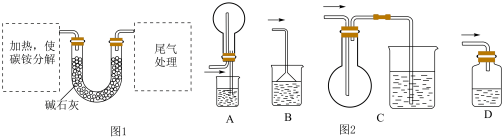
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;
您最近一年使用:0次
2019-10-18更新
|
132次组卷
|
5卷引用:湖南省岳阳县第一中学2018届高三上学期第一次月考化学试题
9 . 某无色气体可能含有CO、CO2和H2O(g)、H2中的一种或几种,依次进行如下处理(假定每步处理都反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,黑色固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色晶体;④通过澄清石灰水时,溶液变得浑浊。由此可以确定原无色气体中( )
| A.一定含有CO2、H2O(g),至少含有H2、CO中的一种 |
| B.一定含有H2O(g)、CO,至少含有CO2、H2中的一种 |
| C.一定含有CO、CO2,至少含有H2O(g)、H2中的一种 |
| D.一定含有CO、H2,至少含有H2O(g)、CO2中的一种 |
您最近一年使用:0次
2019-07-10更新
|
315次组卷
|
8卷引用:2015-2016学年湖南省常德一中高一上12月月考化学试卷
2015-2016学年湖南省常德一中高一上12月月考化学试卷(已下线)2010年西藏拉萨中学高一第二学期期末考试化学试题(已下线)2011-2012学年安徽省马鞍山二中高一下学期期中素质测试化学试卷山东省夏津一中2018-2019学年高一上学期12月月考化学试题【市级联考】山东省滨州市2018-2019学年高一上学期期末考试化学试题陕西省榆林市第二中学2018-2019学年高二下学期期末考试化学试题辽宁省沈阳市浑南区东北育才学校2020届高三预测检测(二)化学试题山东省济钢高级中学2021届高三10月质量检测化学试题
2019·湖南湘潭·一模
10 . 下列关于物质或离子检验的叙述正确的是( )
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.灼烧某白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ |
| C.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
您最近一年使用:0次



